
2.下列各组离子在溶液中能大量共存,且加入过量NaOH溶液后可得到澄清溶液的是( )
A.Na+,Cu2+,Cl-,SO42- B.Al3+,Na+,Cl-,NO3-
C.Ag+,K+,SO42-,Cl- D.K+,Ba2+, HCO3-、C1-
1.下列叙述中不正确的是 ( )
A.“水滴石穿”的原因之一是溶解了CO2的雨水与CaCO3长期作用,生成了可溶性的Ca(HCO3)2
B.长期存放NaOH溶液的滴瓶不易打开,是因为NaOH与玻璃中的SiO2反应,其产物将玻璃粘住
C.塑料袋全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解
D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体
25.(12分)钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g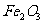 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到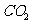 气体
气体
224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的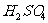 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
I |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量/g |
2.812 |
5.624 |
8.436 |
|
生成气体的体积/L(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
24.(6分)实验室欲测定绿矾中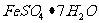 的质量分数。称19绿矾溶解在300ml。水中,再加入硫酸和磷酸。用0.02mol/L
的质量分数。称19绿矾溶解在300ml。水中,再加入硫酸和磷酸。用0.02mol/L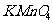 溶液滴定至溶液变粉红色,消耗V mL。已知:
溶液滴定至溶液变粉红色,消耗V mL。已知: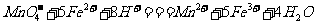 ,
,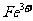 (黄色)
(黄色)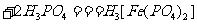 (无色)
(无色)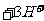 。
。
(1)求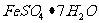 的质量分数。
的质量分数。
(2)简答本实验中磷酸的作用。
23.(10分)
已知:①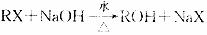
②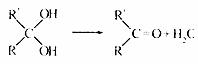 烃A能发生下图所示的一系列化学反应
烃A能发生下图所示的一系列化学反应
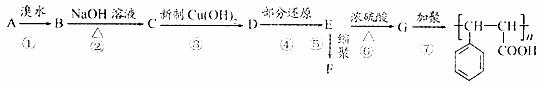
(1)写出下列物质的结构简式:A ,C .E , G 。
(2)写出化学方程式:
② ;
⑤ 。
(3)属于加成反应的有 ,E-G的反应类型是 。
22.(8分)回答下列问题:
(1)由2个C原子、1个O原子、1个N原子和若干食H原子组成的共价化合物,H的原子数目最多为 个。试写出其中一例的结构简式: 。
(2)若某共价化合物分子只含有C、N、H三种元素,且以N(C)和N(N)分别表示C和N的原子数目,则H原子数目最多等于 。
(3)若某共价化合物分子中只含有C、N、O、H四种元素,且以N(C)、N(N)和N(O)分别表示C、N和O的原子数目,则H原子数目最多等于 。
21.(10分)某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下
实验:
Ⅰ.制取氧化铜
①称取2g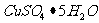 研细后倒入烧杯,加10 mL蒸馏水溶解;
研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述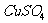 溶液中逐滴加入NaOH溶液。直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
溶液中逐滴加入NaOH溶液。直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是 (填实验序号),步骤①、③中研磨固体所用仪器的名称是 。
(2)步骤③中洗涤沉淀的操作是
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用图装置进行实验,实验时均以生成25 mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
|
实验序号 |
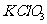 质量 质量 |
其他物质的质量 |
待测数据 |
|
④ |
1.2g |
无其他物质 |
|
|
⑤ |
1.2g |
CuO0.5g |
|
|
⑥ |
1.2g |
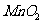 20.5g 20.5g |
|
回答下列问题:
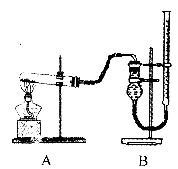
(1)上述实验中的“待测数据”指 。
(2)本实验装置图中量气装置B由干燥管、乳胶管和50 mL,滴定管改造后组装而成,此处所用滴定管是 (填 “酸式”或“碱式”)滴定管。
(3)若要证明实验⑤中干燥管内收集的气体是 ,可待气体收集结束后,用弹簧夹夹
,可待气体收集结束后,用弹簧夹夹
住B中乳胶管,拔去干燥管上单孔橡皮塞,
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a. 。b。CuO的化学性质有没有改变。
20.(10分)由短周期元素组成的X是一种新型的无机材料,X的组成与SiC的结构相似,物理性质相似,符合等电子原理(原子数、电子数相同的互称为等电子体)。由X进行的一系列转化关系如图所示:
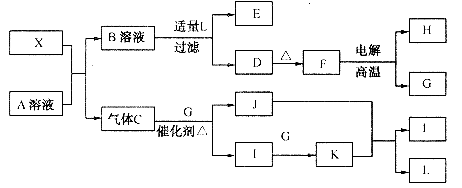
其中,C能使湿润的红色石蕊试纸变蓝;D为白色沉淀;E的焰色呈黄色。请你根据以上信息回答以下问题:
(1)写出C的电子式: 。
(2)写出A与X反应的化学方程式: 。
(3)若将盛有K的烧瓶放在冷水中,可观察到的现象是 ,原因是
(4)若B和L反应时,加入的L过量,则反应过程的离子方程式是
19.(8分)A、B、C、D均为短周期元素,C元素原子最外层电子数是内层电子数的3倍,A和C可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸,B、C的单质可化合生成Z,1mol Z在加热条件下跟水反应的产物需用6mol KOH才能完全中和。B元素组成的单质和D元素组成的单质在一定条件下反应生成化合物N,N和水反应可生成W和D元素的气态氢化物,W是B元素的最高价氧化物对应的水化物。试回答下列问题:
(1)写出下列元素符号:A :B ;C ;D 。
(2)写出下列化合物的化学式:X ;Y ;Z 。
(3)写出下列反应的化学方程式:
N和水反应:
B的单质+Y→X+Z: 。
18.(12分)实验室可用硫化氢通人碘粉末的悬浊液制取一定浓度的氢碘酸。其主要装置如图所示,所用的试剂有:稀盐酸;用ott0法压成的硬方块形CaS;碘在水中的悬浊液;NaOH溶液;NaHS饱和溶液。
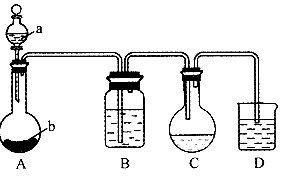
(1)在仪器中盛有的试剂:A中的a为 ,A中的b为 ,B为 ,D为 。
(2)C中反应完全时,应呈现的现象是什么?
(3)D中的导气管末端是否应插入液面以下?请说明理由。
(4)氢碘酸在溶质的质量分数为57%时,可形成“恒沸点”溶液,在125-127℃沸腾出的蒸气中为57%的HI。试设计用C中液体制取57%的氢碘酸的主要方法。
(5)氢碘酸在空气中发雾,应保存于封得很严的暗色瓶中。为防止HI的氧化,在密封之前最好采用的措施是什么?(发挥你的创见)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com