
6.下列反应的离子方程式正确的是
A.醋酸铵溶液和盐酸反应: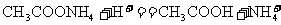
B.氯化亚铁溶液中通入氯气: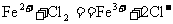
C.向次氯酸钙溶液中通入少量二氧化硫: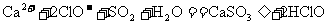
D.向稀氨水中加入稀盐酸: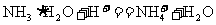
5.设NA代表阿佛加德罗常数,下列说法中正确的是
A.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
B.常温常压22.4L NO气体的分子数小于NA
C.64g的铜发生氧化还原反应,一定失去2NA个电子
D.标况时,22.4L三氧化硫含有的分子数为NA
4.单质X能从盐的溶液中置换出单质Y,由此可知
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y一定是金属
D.当X是非金属时,Y可能是金属,也可能是非金属
3.下列物质中,其水溶液能导电、溶于水时化学键被破坏,且该物质属于非电解质的是
A.I2 B.CO2
C.BaCO3 D.C6H12O6(葡萄糖)
2.若化学反应在等温等压过程中,高温时不自发进行而在低温时可自发进行的条件是
A.△H<0 △S>0 B.△H<0 △S<0
C.△H>0 △S<0 D.△H>0 △S>0
1.下列各项中的“黄色”,不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.在硫化钠溶液中加入双氧水后有黄色沉淀生成
C.食盐在无色的火焰上灼烧时,火焰呈黄色
D.久置的碘化钾溶液呈黄色
21.(8分)在一定条件下,可逆反应:mA+nB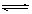 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
20.(9分)
100C时加热NaHCO3饱和溶液,测得该溶液的PH发生如下变化:
|
温度(0C) |
10 |
20 |
30 |
加热煮沸后冷却到50 0C |
|
PH |
8.3 |
8.4 |
8.5 |
8.8 |
甲认为,该溶液的PH升高的原因是HCO3-离子的水解程度增大,所以碱性增强,该反应的离子方程式为 ;乙认为,溶液PH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”) NaHCO3。丙认为甲、乙的判断都不准确,丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,如果产生白色沉淀,则 (填“甲”或“乙”)判断正确,该试剂是 (填编号)
A.氢氧化钡溶液 B.氯化钡溶液 C.氢氧化钠溶液 D.澄清石灰水
(2)将加热后的溶液冷却到100C,若溶液的PH等于8.3,则 (填“甲”或“乙”)。
(3)查阅资料发现,NaHCO3的分解温度为1500C,丙断言 (填“甲”或“乙”)的判断是错误的,理由是 。
19.(15分)
(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为: ______
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 _____
(3)写出Na2CO3在水中的电离方程式:_________________________
(4)写出氯化铁溶液水解反应的离子方程式,并判断溶液的酸碱性:_ 溶液显____性
18.(10分)
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)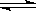 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com