
5.设C(s)+CO2 (g) 2CO(g)△H>0 反应速率为v1 ,N2(g)+3H2 (g)
2CO(g)△H>0 反应速率为v1 ,N2(g)+3H2 (g) 2NH3(g)△H<0 反应速率为v2 ,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(g)△H<0 反应速率为v2 ,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
4.在aL的密闭容器里,于一定温度进行2A(g)+B(g) 2C(g)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是
2C(g)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是
A.2molA和1molB B.1molA和1molB
C.1molA和2molB D.1molB和1molC
3.一定温度下,浓度均为1mol·L-1的A2和B2两种气体,在密闭容器内反应生成气体C,反应达平衡后,测得:c(A2)=0.58 mol·L-1,c(B2)=0.16 mol·L-1,
c(C)=0.84 mol·L-1,则该反应的正确表达式为
A.2A2+B2 2A2B B.A2+B2
2A2B B.A2+B2 2AB
2AB
C.A2+B2 A2B2
D.A2+2B2
A2B2
D.A2+2B2 2AB2
2AB2
2.在恒温、恒容的密闭容器中反应A(g) B(g)+C(g);△H<0(正反应为放热反应)。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需的时间为
B(g)+C(g);△H<0(正反应为放热反应)。若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由0.8mol/L降到0.2mol/L所需的时间为
A.10s B.大于10s C.小于10s D.无法判断
1.决定化学反应速率的根本因素是
A.温度和压强 B.反应物的浓度
C.参加反应的各物质的性质 D.催化剂的加入
21.①~⑨所代表的元素均在元素周期表前4周期,按原子半径递增的顺序进行排列,它们的主要化合价如表所示。其中⑦是过滤金属,且M曾排满,未成对电子数为1,其余为主族元素。
|
代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
半径(pm) |
30 |
64 |
66 |
70 |
106 |
108 |
128 |
186 |
232 |
|
主要化合价 |
+1,-1 |
-1 |
-2 |
-3,+5 |
-2,+4,+6 |
-3,+5 |
+2 |
+1 |
+1 |
(1)元素②在周期表中的位置是 ,②③④中第一电离能最小的元素符号是 。
(2)元素⑤的氢化物的空间构型是 ,元素⑥的氢化物中心原子的杂化方式是 ,
元素④⑥的氢化物的沸点由高到低的顺序是 (填分子式),理由是 。
(3)元素⑨单质晶体的原子堆积方式是 。
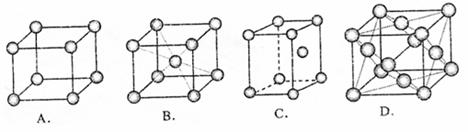
(4)⑦的基态原子核外电子排布式为 ,它的硫酸盐、氯化物、溴化物溶于足量的水以后呈相似的颜色,原因是在这些溶液中都含有相同的配离子是 。
(5)都由元素①③⑤⑧组成的两种化合物发生的离子反应方程式是 。
20.电解法冶炼铝的原料是Al2O3,可由自然界中铝土矿获得。其生产过程可表示为:铝土矿(主要成分Al2O3,杂质SiO2、Fe2O3)→Al(OH)3→Al2O3→Al。
从铝土矿到Al(OH)3的转化有两种方案:
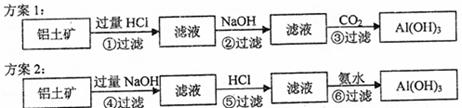
(1)过滤①、②的滤渣成分分别是 、 ;过滤④,⑤的滤渣成分分别是 、 。
A.Al2O3 B.SiO2 C.Fe2O3 D.Al(OH)3 E.H2SiO3 F.Fe(OH)3
(2)“Al(OH)3→Al”的一般的生产方法是 , 。
A.蒸发 B.灼烧 C.热还原
D.溶解 E.过滤 F.电解
(3)如果铝土矿中的Al2O3的质量分数是85%,生产过程的产率是90%,1吨铝土矿可生产铝 千克?
19.阿明洛芬属于苯甲酸类抗炎药,其镇痛效果优于布洛芬。下图是阿明洛芬的一条合成线路。
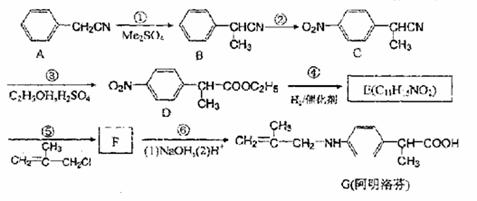
(1)写出下列反应类型:① ,④ 。
(2)写出下列物质的结构简式
E: F:
(3)反应③可以看成是两步反应的总反应,第一步是-CN的完全水解反应形成-COOH,
请写出第二步反应的方程式。
(4)在上述反应步骤中涉及到的有机物A~G中没有手性碳原子的是 (填化合物
的序号)
(5)化合物E的满足下列要求的同分异构体共有 个。(①含有基团 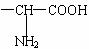 ,
,
②含有对位二取代苯环)
(6)为了促使反应进行,反应⑤要在 条件下进行。(填“酸性”或“碱性”)
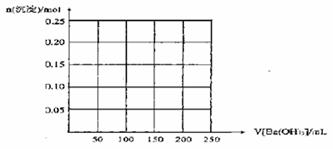
18.(1)向含有0.1mol明矾的溶液中,逐滴加入一定浓度的NaOH溶液,当NaOH的体积是30mL和190mL时,反应体系中沉淀的质量相等,则NaOH溶液的质量的量浓度是 ;若继续加入上述NaOH溶液,当NaOH溶液的体积为 mL时,反应体系中的沉淀恰好完全溶解。
(2)如果上述明矾溶液中滴加1mol/L的Ba(OH)2溶液,请在下图中画出反应体系中产生的两种沉淀的总物质的量随Ba(OH)2溶液体积V的变化曲线。当溶液中沉淀的总物质的量最大时,沉淀的质量是 g,体系中能出现的沉淀的最大质量是 g。
17.KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
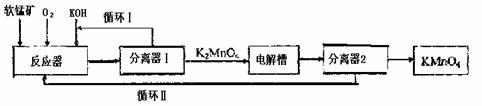
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com