
21.关于酸碱中和滴定
(1)准确量取25.00ml高锰酸钾溶液,选用的仪器是 (酸式或碱式)滴定管。
(2)一只规格为a mL的滴定管,其尖嘴部分充满溶液,管内液面在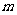 mL处,当液面降到
mL处,当液面降到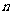 mL处时,流出液体的体积为
ml。
mL处时,流出液体的体积为
ml。
(3)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项 。

|
|
锥形 瓶中 溶液 |
滴定 管中 溶液 |
选用 指示剂 |
选用 滴定管 |
|
A |
碱 |
酸 |
石蕊 |
(甲) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
(4)某学生用0.1mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.量取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填写:
①正确操作步骤的顺序是(用序号字母填写) ;
②判断到达滴定终点的实验现象是 ;
③滴定过程中眼睛 ,左手 ,右手 ;
20.现将足量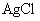 分别放入下列物质中,
分别放入下列物质中,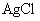 的溶解度由大到小的排列顺序是
( )
的溶解度由大到小的排列顺序是
( )
①20ml 0.01mol·L-1 KCl溶液
②30ml 0.02mol·L-1 CaCl2溶液
③40ml 0.03mol·L-1 HCl溶液
④10ml蒸馏水
⑤50ml 0.05mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>③>⑤>②>①
C.⑤>④>②>①>③ D.④>①>③>②>⑤
19.在0.1mol·L-1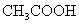 溶液中存在如下电离平衡:
溶液中存在如下电离平衡:

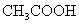

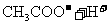 ,对于该平衡,下列叙述正确的是
( )A.加入水时,平衡向逆反应方向移动
,对于该平衡,下列叙述正确的是
( )A.加入水时,平衡向逆反应方向移动
B.加入少量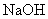 固体,平衡向正反应方向移动
固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中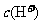 减小
减小
D.加入少量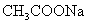 固体,平衡向正反应方向移动
固体,平衡向正反应方向移动
18.室温时,下列混合溶液的pH一定小于7的是
( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
17.若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
( )
A.10:1
B.5:1 C.1:1
D.1:10 
15. 室温下,在pH=11的某溶液中,由水电离的
室温下,在pH=11的某溶液中,由水电离的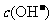 为
( )
为
( )
①1.0×10-7mol·L-1 ②1.0×10-6 mol·L-1
③1.0×10-3 mol·L-1 ④1.0×10-11 mol·L-1
A.③ B.④ C.①③ D.③④
 16.
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰被完全中和时,消耗盐酸和醋酸溶液的体积分别为
16.
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰被完全中和时,消耗盐酸和醋酸溶液的体积分别为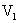 和
和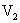 ,则
,则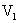 和
和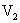 的关系正确的是
( )
的关系正确的是
( )
A.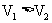 B.
B.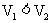 C.
C.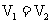 D.
D.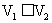

14. 工业上制备纯净的氯化锌时,将含杂质的氧化锌溶于过量的盐酸,为了除去杂质需要调节溶液的pH到4,应加入试剂是 ( )
工业上制备纯净的氯化锌时,将含杂质的氧化锌溶于过量的盐酸,为了除去杂质需要调节溶液的pH到4,应加入试剂是 ( )
A.氢氧化钠
B.氨水 C.氧化锌 D.氯化锌
13.将0.1mol·L-1的醋酸钠溶液20mL与0.1mol·L-1盐酸10mL混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是
( )
A.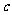
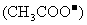 >
>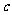
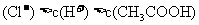

B.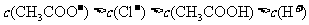

C.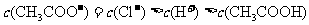

D.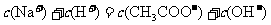

12.下列溶液蒸干后,能析出溶质固体的是
( )
①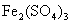 ②
② 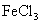 ③
③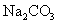 ④
④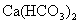

A.仅①③ B.仅①③④ C.仅③ D.全部
11. 物质的量浓度相同的三种钠盐,
物质的量浓度相同的三种钠盐,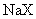 、
、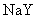 、
、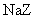 的溶液,其
的溶液,其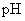 依次为8、9、10,则
依次为8、9、10,则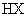 、
、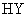 、
、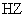 的酸性由强到弱的顺序是
( )
的酸性由强到弱的顺序是
( )
A.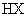 、
、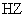 、
、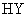 B.
B.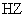 、
、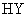 、
、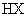

C.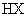 、
、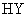 、
、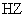 D.
D.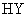 、
、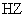 、
、

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com