
23.(9分)在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应:
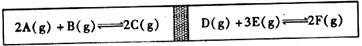
A、B、C、D、E、F的起始加入量分别为2 mol、1 mol、0 mol、X mol、Y mol、Z mol,两边反应达平衡后,隔板恰好在正中间位置。
(1)恒温时,若向左边容器中充入0.3 mol He,则右边容器内的平衡向_______移动(填“左”、“右”或“不”);
(2)恒温时,若向左边容器中通入的不是He,而是2 molA和1 molB的气体,与原平衡相比,C的体积分数__________(填“增大”、“减小”或“不变”,下同)右边容器中气体平均相对分子质量__________;
(3)恒温时,在(2)题的平衡体系中,若向左右两容器中同时再各注入1molHe,平衡后与(2)题的原平衡体系相比,下列说法正确的是__________(填序号)。
A.C、F的浓度都不变 B.B的转化率、F的分解率均增加
C.A、D物质的量都增加了 D.A、B、C、D、E、F物质的量都不变
22.(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分产物已略去)。请按要求回答下列问题:
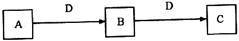
(1)若D为强氧化性单质,则A可能是__________(填序号);
a.S b.N2 C.Na d.Mg e.Al
(2)若D为用途极广的某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量的D,理由是__________________________________________________。
(3)若D为强电解质,A和C在溶液中反应生成的B是白色絮状沉淀,则B的化学式为__________,A和C反应的离子方程式是______________________________。
21.(10分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A、D同主族,C、E同主族,D、E、F同周期。A、B的原子最外层电子数之和与C原子的最外层电子数相等。A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态。A能分别与E、F形成电子总数相等的气体分子。
请问答下列问题:
(1)A-F六种元素原子,原子半径最大的是__________(填对应的元素符号,下同);
(2)A与B两种元素组成一种阳离子,该离子的检验方法为____________________。
(3)C、D两种元素组成的化合物中,既含有离子键,又含有非极性共价键,该化合物的电子式为________________;
(4)E、F两种元素中非金属性较强的是__________,能够证明这一结论的化学事实是__________________________________________________。
20.(11分)Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用下图1中给出的仪器设计了图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。

(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是________________________________________;
(2)学生乙对学生甲设计的实验装置进行了完善(如下图3)。实验室中可供选择的药品:Zn、浓H2SO4、稀H2SO4、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:
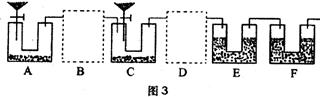
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为__________,U型管内药品为__________;装置F的作用为________________________________________;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将__________(填“偏高”、“偏低”或“无影响”);
④如果实验后E装置质量增重3.96g,则该Na2CO3试样的纯度为__________。
19.(7分)铁及其化合物之间的相互转化可用下式表示:
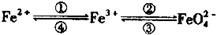 (高铁酸根离子)
(高铁酸根离子)
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是__________(选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应: (CuFeS2中S为-2价)。则下列说法正确的是__________(选填序号);
(CuFeS2中S为-2价)。则下列说法正确的是__________(选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol 时,有46g CuFeS2参加反应
时,有46g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是____________________。
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应

 ,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是
,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是
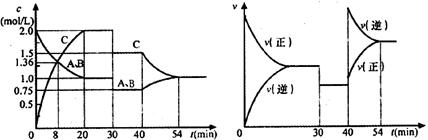
A.在30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为
C.反应方程式中的 ,正反应为放热反应
,正反应为放热反应
D.20min~40min间该反应的平衡常数均为4
第Ⅱ卷(非选择题 共54分)
17.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且与c、e反应时有明显的现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是
A.a一定为KOH B.b一定为KHSO4
C.c一定为AlCl3 D.e一定为MgCl2
16.将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中情况的一组物质是
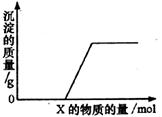
|
|
X |
Y |
|
A |
Ba(HCO3)2溶液 |
NaOH溶液 |
|
B |
KOH溶液 |
Mg(HSO4)2溶液 |
|
C |
Na2CO3溶液 |
CaCl2溶液 |
|
D |
CO2气体 |
石灰水 |
15.今有室温下四种溶液,有关叙述不正确的是
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中
D. ④与
④与 ②溶液混合,若混合后溶液pH=4,则
②溶液混合,若混合后溶液pH=4,则
14.短周期元素A、B、C原子序数依次递增,它们的原子最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列有关叙述正确的是
A.原子半径A<B<C
B.A元素氢化物的稳定性小于C的氢化物
C.B与C的单质都可与烧碱溶液反应
D.B单质在一定条件下能与A的氧化物剧烈反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com