
3.既可用于鉴别乙烷与乙烯,又可用于除去乙烷中的乙烯以得到乙烷的方法是
A.通过氢氧化钠溶液 B.通过溴水
C.通过酸性高锰酸钾溶液 D.通过浓盐酸
2.下列说法正确的是
A.非金属氧化物都是酸性氧化物
B.BaSO4难溶于水,是弱电解质
C.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力
D.可以利用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖
1.硒被称为主宰生命的元素之一,人们研究开发了一种含有钙、铁、锌、硒的保健品。对此下列说法正确的是
A.四种元素均处于第四周期,且均是主族元素
B.H2Se比H2O热稳定性好
C.单质钙能从FeSO4溶液中置换出铁
D.保健品为人体提供了必需的Fe、zn、Se等微量元素
22.(8分)Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度。
(1)现需配制250mL 0.100mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250rnL 容量瓶、玻璃棒外,还需要 。
(2)需准确称取Na2S4O3固体的质量为 g。
(3)另取废水50.00mL,控制适当的酸度加人足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O2溶液36.00mL。已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度.
21.(13分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
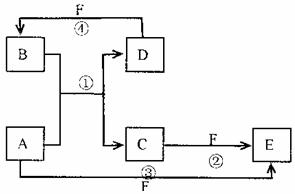
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 ,反应④的化学方程式为 。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,已知常温下lg D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 ,B固体属于 晶体。
20.(8分)有机物A的结构简式为:
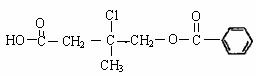
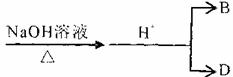
(1)A的分子式为 ;
(2)lmol A与NaOH溶液反应时,最多消耗NaOH mol;
(3)B在一定条件下自身分子内可以发生酯化反应生成不同的环状酯,请写出其中的一种五元环状酯的结构简式 ;
(4)D的某同系物在O2中充分燃烧后,产物n(CO2):n(H2O)=3:2,该同系物的分子式为 。
19.(17分)下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去)。请根据下列要求回答问题。
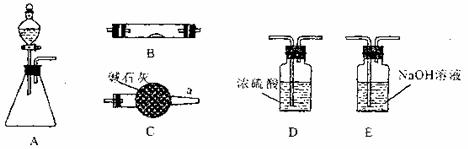
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末。此实验的目的是 。
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种) 。
③加热前必须进行的操作是 。
(2)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中装过氧化钠固体,验证SO2气体与过氧化钠反应时是否有O2生成。
①SO2与过氧化钠反应生成O2的方程式可能为: ;
②根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母);( )→( )→( )→( )→( );(可以不填满,也可以补充)
装置B中可能观察到的现象是 。
③验证有O2产生的方法是: 。
④有同学认为B装置后要接装置C或装置D或装置E,你的选择是 ,其理由为: 。
18.(8分)常温下,干燥的混合气体可能由H2S、H2、Cl2、SO2、NH3、NO2、NO、CO2和O2中的某几种组成。现进行如下实验:
①混合气体无色,其密度比空气密度大;
②混合气体不能使湿润的品红试纸褪色,打开瓶塞无颜色变化;
③混合气体通过浓硫酸时出现混浊,但气体的体积变化不明显,再通过碱石灰,气体体积缩小到原来的10%;
④上述通过碱石灰的混合气体,若点燃会爆炸,恢复到常温时。剩余气体体积为通过浓硫酸和碱石灰之前的原混合气体的2.5%,若使其通过赤热的铜网,铜网表面变黑。
⑤当原混合气体通过硫酸铜溶液时,剩余气体为原来的90%。
根据以上实验,回答下列问题:
(1)原混合物气体中一定含有 ,一定不含有 。
(2)原混合气体的平均摩尔质量为 。
17.(6分)三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应物有:HF、N0、HNO3。请根据要求回答下列问题:
(1)写出该反应的化学方程式: 。反应过程中,被氧化与被还原元素的物质的量之比 。
(2)若反应中生成0.2mol HNO3,转移的电子数目为 个。
16.如下图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是 ( )
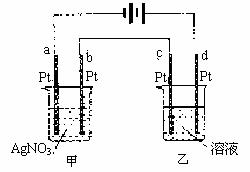
A.甲池是b极上析出金属银,乙池是c极上析出某金属
B.甲池是a极上析出金属银,乙池是d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
第Ⅱ卷(非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com