
5.下列说法中正确的是
A.能自发进行的反应都是放热反应
B.凡是熵增加的反应一定能自发进行
C.在一定条件下,某些吸热反应可以自发进行
D.放热的熵增加的反应不一定能够自发进行
4.下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
3.下列关于化学基本原理和基本概念的几点认识中正确的是
A.胶体区别于其他分散系的本质特征是丁达尔现象
B.25℃时,纯水中氢离子的物质的量浓度为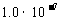 mol/L
mol/L
C.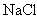 既可表示氯化钠的元素组成,又能表示其分子结构
既可表示氯化钠的元素组成,又能表示其分子结构
D.强电解质溶液的导电能力强于弱电解质溶液
2.能使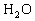

 电离平衡向正向反应方向移动,而且所得溶液呈酸性的是
电离平衡向正向反应方向移动,而且所得溶液呈酸性的是
A.将水加热到100℃,使水pH=6
B.在水中加入氯化铜固体
C.在水中加入小苏打
D.在水中滴入稀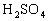
1.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措中违背了这一指导思想的是
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油技术,降低机动车辆尾气中有害气体排放
C.生产、生活中,努力实现资源的循环利用
D.提高石油、煤、天然气产量,以满足工业生产快速发展的需求
29.(8分)某同学在加热条件下反应制备氯气,并将制备的氯气进行相应定量、定性分析试验,回答下列问题:
(1)将2L 12 mol/L浓盐酸与174 g MnO2在加热条件下反应,理论上最多可制得氯气在标准状况下的体积为_________________
(2)将制备的2.24L氯气(标准状况)通入到800mL碘化亚铁溶液中,充分反应后,测得溶液中Fe2+和Fe3+物质的量相等,则原碘化亚铁溶液的物质的量浓度为_________________
(3)将制备的4.48L氯气(标准状况)与过量石灰乳反应制取漂白粉,理论上最多可制得Ca(ClO)2的质量为_________________
(4)已知氯气和热NaOH溶液反应生成NaCl和NaClO3,尾气用滴有酚酞的足量的热NaOH溶液吸收,溶液的红色变浅但未褪色,若吸收含42.6g氯气的尾气,则生成的NaClO3的物质的量__________________
28.(18分)
I.下列叙述中没有错误的是 ( )
A.检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180度,再倒过来,看是否漏水。
B.溴水中通入SO2后,颜色褪去,说明SO2表现了漂白性
C.除去氯化铵溶液中的氯化铁:向溶液中滴加适量氢氧化钠溶液,过滤
D.物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
E.检测等物质的量浓度H3PO4和H2SO4的酸性强弱,比较磷和硫两元素非金属性的强弱
F.用量筒测得排水法收集制得的氢气体积为50.28mL
II.某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)如何检查该装置的气密性__________________________
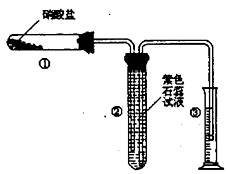
(1)甲同学加热的是Cu(NO3)2。通过观察到的现象分析得出Cu(NO3)2受热分解的化学方程式为:2Cu(NO3)2 2CuO+4NO2↑+O2↑则加热过程观察到的现象为:装置①的现象为_________,装置②的现象为_______________________。
2CuO+4NO2↑+O2↑则加热过程观察到的现象为:装置①的现象为_________,装置②的现象为_______________________。
(2)乙同学加热的是NaNO3。他通过观察到的现象分析写出了该NaNO3受热分解可能的两种化学方程式:
①2NaNO3

针对乙同学提出的两种可能的分解方式,请你设计一个简单的实验帮助乙同学证明NaNO3按哪种受热方式分解的:____________________________________________
____________________________________________________________:(用必要文字描述操作、现象、结论)丙同学根据乙同学的设计方案重做该实验,通过观察到的现挈,得出NaNO3受热分解化学方程式:2NaNO3 2NaNO2+O2↑
(3)丁同学加热的是AgNO3。丁同学通过观察到的现象得出AgNO3受热分解化学方程
式:2AgNO3
(4)由上述甲、丙、丁三位同学的结果,请你推测:硝酸盐受热分解的产物可能与_____________有关。
27.(17分)物质之间的转化关系如下图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质。常温下,X是一种液态化合物,F为常见的红棕色防锈油漆颜料的主要成分,O是常见含氮量最高的氮肥,A、E、J、N中含有同一种元素。
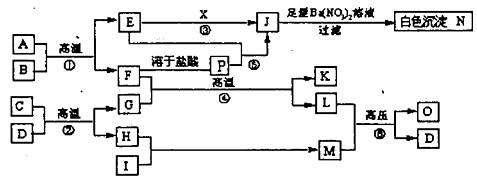
回答下列问题:
(1)X的化学式为_________________,X的分子属于__________________(填“极性”或“非极性)分子;写出反应⑤的离子反应方程式_____________________________。
(2)C+D的反应化学方程式为__________________,在高温的条件下,向一个密闭容器中投入1molC和2molD,反应一段时间后,测得C的转化率为50%,则D的转化率为_______________;这时混合气体的平均相对分子质量为________________。
(3)K和D在一定条件下反应也能生成H,写出其化学方程式________________,写出反应⑥的化学方程式________________________________________________。
(4)现有1mol A参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为__________________________________。
26.(17分)A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大。元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多l,B、C、F的质子数之和等于E、G的质子数之和.请回答下列问题
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式_________________(至少写出四种)
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为_________________________________(用化学式表示)
(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由C、D、E三种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式___________________、___________________
(4)D、E二种元素的原子都能形成相应的离子,则两离子半径大小关系为_______________(用离子符号表示);将D、E二种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体物质剩余,则所投入到水中的D的单质和E的单质的质量之比为__________________,上述反应的化学方程式为____________________________________;若D的单质的物质的量为xrnol,则上述反应中得到另一物质的物质的量为__________________。
13.将一定体积稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积为Vl;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(Vl和V2都在同一条件下测定),已知V2=3Vl,则稀硝酸和稀硫酸的物质的量浓度之比为( )
A.1:1 B.l:2 C.1:3 D.无法确定
第Ⅱ卷 非选择题(共174分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com