
6.可逆反应CO+NO2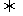 CO2+NO的反应速率与反应物浓度的关系为v=KC(NO2)。一定温度下,该反应在一定体积的密闭容器中达到平衡状态,此时向容器中充入一定量的CO气体,下列叙述错误的是
CO2+NO的反应速率与反应物浓度的关系为v=KC(NO2)。一定温度下,该反应在一定体积的密闭容器中达到平衡状态,此时向容器中充入一定量的CO气体,下列叙述错误的是
A.正反应速率增大,平衡向正反应方向移动
B.浓度商Qc减小,平衡向正反应方向移动
C.反应物的焓增大,平衡向正反应方向移动
D.CO气体分压增大,平衡向正反应方向移动
5.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++eˉ=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
4.下列各组物质之间反应,调节反应用量,离子方程式不变的是
A.石灰水和SO2 B.Na[Al(OH)4]和CO2
C.Ba(OH)2溶液和H2SO4溶液 D.NaHCO3溶液和石灰水
3.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,lL液态水中含有的H+数目大于10-7NA
B.足量Zn与一定量的浓硫酸反应,标准状况下产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0. 1 NA
D.1molFeCl3水解生成NA 个胶体粒子
2.“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是
A.该反应属于氧化还原反应 B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质 D.配平后甲、乙、丙的化学计量数均为2
1.英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生。波义耳指出:我指的元素应当是某些不由任何其它物质所构成的原始的和简举的物质或完全纯净的物质,是具有一定确定的、实在的、觉察到的实物,它们应该是用一般化学方法不能再分解为更简单的某些实物。从现代化学的观点看,波义耳定义的元素实际为
A.原子和分子 B.纯净物 C.单质 D.化合物
37.(4分)室温下向含有NaOH和Ba(OH)2的溶液20mL中,边震荡边滴加0.05mol·L-1的硫酸溶液。当加入20mL时,沉淀量刚好达到最大;当加入硫酸60mL时,恰好达到中和。计算混合溶液中NaOH和Ba(OH)2溶液的物质的量浓度分别为多少?
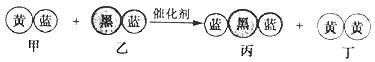
36.(11分)①②③④⑤五种元素,在元素周期表中的位置如图所示.回答下列问题:
(1)①②③④⑤五种元素中,金属性最强的元素在周期表中位置是 ,
(2)元素①和③可以形成众多的化合物,其中最简单的是(写结构式) , 该化合物中,化学键的类型为 (填“离子键”或“共价键”)。
(3)写出元素④的单质的电子式 ,该元素的最高氧化物的水化物的稀溶液能与Cu发生反应,该反应的离子方程式 .
(4)画出元素⑤的原子结构示意图 ,其单质气态时的颜色为 ,该单质的重要用途之一是制漂白粉,写出工业制漂白粉的化学方程式为 。
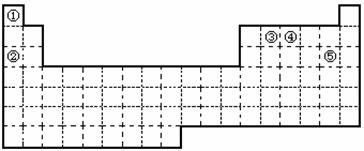
35.(8分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。
(1)写出该反应的反应方程式 ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ; 烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
34.(8分)已知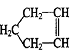 可简写为
可简写为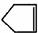 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: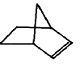
(1)降冰片烯属于__________。(填序号)
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯不具有的性质__________。(填序号)
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(4)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com