
27.(13分)
苯酚遇FeC13溶液发生显色反应,其原理如下:
Fe3 + + 6C6H5OH  [Fe(C6H5O)6]3一+6H+
[Fe(C6H5O)6]3一+6H+
黄色 紫色
(1)在FeC13与C6H5OH混合溶液中加入适量铁粉,溶液变为浅绿色。则该反应的离子方程式为_____________________________________________________:该反应中每消耗0.2 mol 氧化剂,转移电子为_________________moL。
若在 FeC13 与 C6H5OH 的混合溶液中滴入足量 NaOH 溶液,可观察到有红褐色沉淀产生。则上述平衡__________移动(填“向左”、“向右”或“不”)。
(2)在苯酚钠中逐滴加入酸化的 FeCl3溶液,可依次出现红褐色沉淀一沉淀溶解一溶液显紫色一紫色变浅(或溶液由紫色变为黄色)等几种变化。请回答:
①开始时出现红褐色沉淀的原因是(用分步写出的离子方程式表示)
_______________
②最后紫色变浅或变为黄色的原因是(用文字表述)__________________________
______________________________________________________________________。
13.某同学按下图所示的装置进行试验。 A、 B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是( )
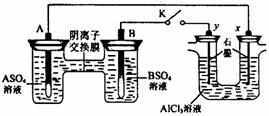
A.溶液中。(A2+)浓度减小
B.B的电极反应:B-2e-==B2+
C.y电极上有 H2 产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
第Ⅱ卷(非选择题,共174分)
A、B、C、D、E为原子序数依次增大的五种短周期元素。A、E 同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D 最外层电子数之和与 E 的核外电子总数相等。试回答:
(1)E在周期表中的位置为_______周期_______族。
(2)A、C、E三种元素的原子半径由大到小的顺序是________(用元素符号填写)。
(3)化合物BA4的空间构型为___________________,化合物 ABC中化学键类型为
__________________,它属于___________分子(填“极性”或“非极性”)。
化合物 C2A2是一种高能量分子,且C 原子满足 8 电子稳定结构。写出 C2A2的电子式_______________________________________
(4)A、D、E 三种元素可形成一种离子化合物 R,用惰性电极电解 R 的稀溶液的反应方程式为_________________________________;电解一段时间后,溶液 pH_____(填“增大”、“减小”或“不变”)。
(5)在0 . l mol·L-1E2BD3 的溶液中,各离子浓度由大到小的顺序是_______ ____;分子式为 A2B2D4 的化合物,与等物质的量的KOH溶液反应后溶液呈酸性,其原因是(用文字表述)________________________
______________________________________________________________________。
12.在盛有足量A的体积可变的密闭容器中,加入B ,发生反应:A (s) + 2B (g) 4 C(g) + D (g);△H < 0 。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的 B 的物质的量的变化关系如下图。下列说法正确的是( )
4 C(g) + D (g);△H < 0 。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的 B 的物质的量的变化关系如下图。下列说法正确的是( )
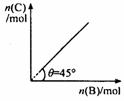
A.平衡时 B 的转化率为 50 %
B.若再加入B ,则再次达到平衡时正、逆反应速率均增大
C.若保持压强一定,再加入B ,则反应体系气体密度减小
D.若保持压强一定,当温度升高10 ℃ 后,则图中 θ > 45°
11.已知:
CH3 (CH2 )2CH3
(g)+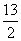 O2 (g) =4CO2 (g) + 5 H2O (l);△H=-2878kJ·mol-1
O2 (g) =4CO2 (g) + 5 H2O (l);△H=-2878kJ·mol-1
(CH3)2CHCH3
(g) +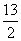 O2 (g) =4CO2 (g) + 5 H2O (l);△H =-2869 kJ·mol-1
O2 (g) =4CO2 (g) + 5 H2O (l);△H =-2869 kJ·mol-1
下列说法正确的是 ( )
A.正丁烷的燃烧热为一2878kJ·mol一1
B.正丁烷分子所具有的能量大于异丁烷分子
C.等量的异丁烷分子中碳氢键比正丁烷的多
D.异丁烷转化为正丁烷的过程是一个放热过程
10.25℃ 时,将 pH = 3 的 HA 溶液与 pH = 11 的 BOH 溶液等体积混合,所得溶液 pH 小于7。下列说法不正确的是 ( )
A.HA 为弱酸
B.混合溶液中加水稀释,溶液导电能力增强
C.混合溶液中滴加氨水至溶液的 pH = 7,所得溶液中 c (A-)=c(NH4+)+ c (B+)
D.升高混合溶液温度,其 pH 更小
9.一种有机玻璃的结构如下图所示。关于它的叙述不正确的是 ( )
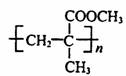
A.该有机玻璃是一种线型结构的高分子材料
B.该有机玻璃的化学名称为聚甲基丙烯酸甲酯
C.可用过滤方法除去 CCl4 中的少量该有机玻璃
D.它在一定条件下发生水解反应时, C-O键发生断裂
8.下列离子方程式书写正确的是 ( )
A.硫化钠水解:S2- + 2H2O = H2S + 2OH一
B.过量CO2通入Ca (ClO)2溶液中:CO2 + H2O + Ca2+ =CaCO3↓ + 2H+
C.氯化铝溶液中加入过量氨水:Al3+ + 4 NH3·H2O = AlO2一+ 4NH4+ + 2 H2O
D.NH4HSO4溶液中加入等物质的量的Ba (OH)2 :
NH4+ + H+ + SO42一+ Ba2+ + 2OH一 = NH3·H2O + BaSO4↓+ H2O
7.设 NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A.常温常压下,100mL0 . 1 mol·L-1, HCOOH 溶液中含 H+数目为 0 . 0lNA
B.标准状况下,22 . 4L 氯仿所含的分子数为 NA
C.室温下,42 . 0g 乙烯和丙烯的混合气体中含有的碳原子数为 3NA
D.一定条件下,向密闭容器中加入l mol N2和3molH2,反应结束后,转移的电子数为6NA
6.下列叙述及对应说明不正确的是 ( )
A.金刚石的熔沸点高于晶体硅,因为 C-C 键比 Si-Si键强
B.稀有气体的晶体属于原子晶体,因为其构成微粒是原子
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.丝织品不能用加酶洗衣粉洗涤,因为蛋白质在酶的作用下易水解
22.(13分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
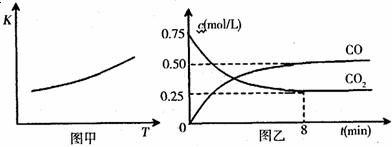
(1)该反应的平衡常数表达式K=
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8min内,CO的平均反应速率v(CO)= mol/(L·min)。
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量CO D.再加入一些铁粉
(4)铁及其化合物之间的相互转化可用下式表示:
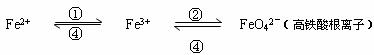
回答下列有关问题:
(a)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(b)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)
则下列说法正确的是 (选填序号);
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2 既作氧化剂又作还原剂
D.当转移1mol电子时,46 g CuFeS2参加反应
(c)高铁酸钠生产方法之一是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 高铁酸钠是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3。高铁酸钠作为水处理剂发挥的作用是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com