
6.下列说法中,不符合ⅦA族元素性质特征的是 ( )
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.从上到下单质的氧化性逐渐减弱 D.从上到下氢化物的稳定性依次减弱
5.关于晶体的下列说法正确的是 ( )
A.任何晶体中,若含有阳离子就一定有阴离子
B.原子晶体中只含有共价键
C.原子晶体的熔点一定比金属晶体高
D.离子晶体中只含有离子键,不含有共价键
4.下列能跟氢原子形成最强极性键的原子是 ( )
A.F B.Cl C.Br D.I
3.下列各原子或离子的电子排布式错误的是 ( )
A.Na+:1s22s22p6 B.F:1s22s22p5
C.O2-:1s22s22p4 D.Ar:1s22s22p63s23p6
2.一个电子排布为1s22s22p63s23p1的元素最可能的价态是 ( )
A.+1 B.+2 C.+3 D.-1
1.在物质结构研究的历史上,首先提出原子内有电子学说的科学家是 ( )
A.道尔顿 B.卢瑟福 C.汤姆生 D.波尔
22、已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
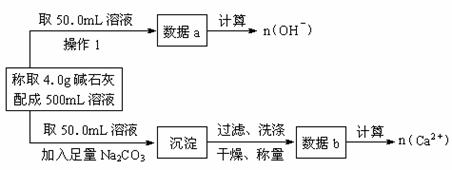
①写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca (OH)2 |
NaOH、 Ca (OH)2 |
NaOH、 Ca (OH)2、H2O |
|
n (Na+)、n (Ca2+) 的关系 |
40x+56y = 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰中各成分的质量分数。
21.(14分)已知在pH为4-5的溶液中,Cu2+ 几乎不水解,而Fe3+ 几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.其实验流程图如下:
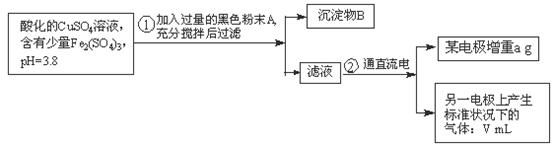
试回答下列问题:
(1)步骤①中加入A的化学式为 ,沉淀物B是 (填化学式)。
(2)步骤②中所用部分仪器如下图所示,则A应连接直流电源的 ___极,请写出B电极上发生反应的电极方程式: __________。
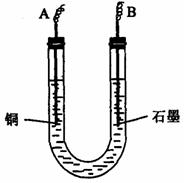
(3)下列实验操作属必要的是_____ (填字母)。
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.在空气中烘干电极,必须采用低温烘干法
E.电极在烘干称重的操作中必须按如下顺序:烘干→称重→再烘干→再称重进行至少两次
(4)电解后向溶液中加入石蕊试液,观察到的现象是 。
(5)铜的相对原子质量的计算式是___ ______________。
20.(7分)如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答:
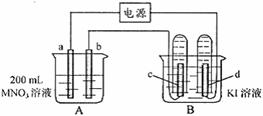
(1)a为 极,c极的电极反应式为: 。
(2)电解开始时,在B烧杯的中央滴几滴淀粉溶液,你能观察到的现象是
。电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为: 。
(3)当d电极上收集到44.8 ml气体(标准状况)时停止电解,a极上放出了 mol气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为 g·moL-1。
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200 ml,取这种溶液加入到25.0 ml 0.100 mol·L-1的HCl溶液中,当加入31.25 ml 溶液时刚好沉淀完全。由此可知电解前A烧杯中MNO3溶液的物质的量浓度为 mol·L-1。
19.(12分)A-J是中学化学中常见的几种物质,它们之间的转化关系如下图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作禽流感、SARS等病毒的杀菌消毒剂。
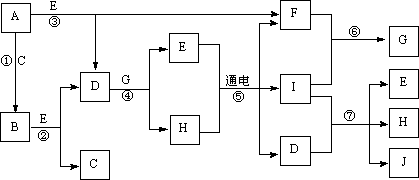
(1)写出E的电子式:_____________________。
(2)写出反应⑦的离子方程式:_________________________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则阳极的电极反应式为:____________。________极(填“阴”或“阳”)附近溶液由无色变为红色,其原因是:__________________ _
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com