
9.下列离子方程式书写正确的是
A.铁跟盐酸反应: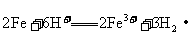
B.碳酸氢钙溶液跟过量的氢氧化钠溶液反应: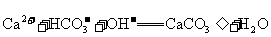
C.次氯酸钙溶液中通入过量的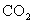 :
: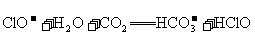
D.氯化铝溶液与过量的氨水反应: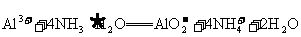
8.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L的苯中含有0.3 NA个碳碳双键
B.120gNaHSO4晶体中所含的离子总数为3NA
C.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.VLamoL/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
7. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度.高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。下列说法正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度.高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。下列说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于第ⅢA族,可推知氮化镓化学式为Ga3N2
C.工业上可用金属铝与V2O5在常温下冶炼钒,铝作还原剂
D.ETFE膜(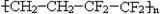 )是一种可焊接的塑料
)是一种可焊接的塑料
6.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.CO2的分子式: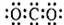 C.乙烯的结构简式:C2H4
C.乙烯的结构简式:C2H4
B.Cl-的结构示意图: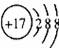 D.质量数为37的氯原子:
D.质量数为37的氯原子: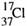
21.(8分)将0.3 mol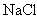 固体与0.1
mol
固体与0.1
mol 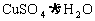 固体混合溶于水,配成1000mL混合液。然后取出200mL溶液,用石墨作电极,通电电解(不考虑水解)。试回答:
固体混合溶于水,配成1000mL混合液。然后取出200mL溶液,用石墨作电极,通电电解(不考虑水解)。试回答:
(1)在电解的开始阶段,阴极上发生的电极反应式为:___________________。
(2)当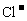 恰好放电结束时,阴极上产生气体的体积为_______升(标准状况下);此时所得溶液的pH为___________(假设溶液体积不变)。
恰好放电结束时,阴极上产生气体的体积为_______升(标准状况下);此时所得溶液的pH为___________(假设溶液体积不变)。
(3)当放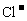 电结束后,若溶液进一步电解,此时发生电解的化学方程式为:___________。
电结束后,若溶液进一步电解,此时发生电解的化学方程式为:___________。
20.(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为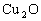 /
/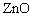 ):
):

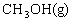
根据题意完成下列各题:
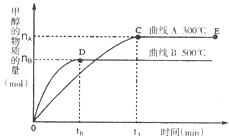
(1)反应达到平衡时,平衡常数表达式K=________________,升高温度,K值_______(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡状态,氢气的平均反应速率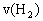 =____(用
=____(用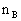
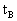 表示)。
表示)。
(3)在其它条件不变的情况下降低温度,则逆反应速率______(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率___________。
(4)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的l/2,下列有关该体系的说法正确的是________
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时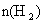 /
/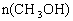 增大
增大
19.(10分)
(1)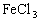 的水溶液呈_______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_________________________;实验室在配制
的水溶液呈_______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_________________________;实验室在配制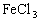 的溶液时,常将固体
的溶液时,常将固体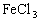 先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”、“抑制”)其水解。
先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”、“抑制”)其水解。
(2)把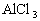 溶液蒸干、灼烧,最后得到的主要固体产物是___________。
溶液蒸干、灼烧,最后得到的主要固体产物是___________。
(3)在0.1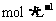 的
的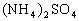 溶液中,各种离子浓度由大到小的顺序为:___________。
溶液中,各种离子浓度由大到小的顺序为:___________。
18.(10分)能源是人类生存和发展的重要支柱。研究化学反应中的能量变化在能源紧缺的今天具有重要的意义。已知下列热化学方程式:
①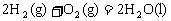
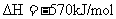 ;
;
②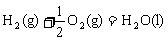
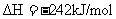 ;
;
③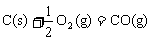
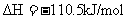 ;
;
④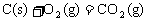
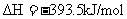 ;
;
⑤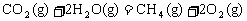

回答下列问题:
(1)上述反应中属于放热反应的是(填序号)____________。
(2) 的燃烧热为_______________。
的燃烧热为_______________。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测量,但可通过间接的方法求得。根据以上反应的 值求出反应
值求出反应
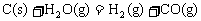 的
的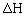 =_________________________;
=_________________________;
该反应的熵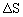 ___________0(选填“>”、“=”、“<”);
___________0(选填“>”、“=”、“<”);
又已知: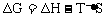 (T指温度),当
(T指温度),当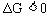 时可自发进行。则该反应在什么条件下可自发进行_________________。
时可自发进行。则该反应在什么条件下可自发进行_________________。
17.(12分)某研究小组对铁生锈进行研究。
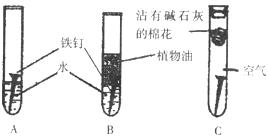
(1)甲同学设计了A、B、C一组实验(如上图),探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈,C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是_____________________;
②铁钉发生电化腐蚀的正极电极反应式为 __________________________。
③实验B所用的水要经过_______处理,植物油的作用是______________;
④实验C中碱石灰的作用是_____________________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下;请回答:
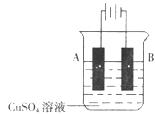
①A电极对应的金属是______(写元素名称),B电极的电极反应式是___________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:_________________。
16.下图是在恒温下某化学反应的反应速率随时间变化的示意图。下列说法不符合该示意图的是
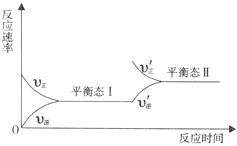
A.反应达到平衡时,正反应和逆反应速率相等
B.该反应达到平衡I以后,增大反应物的浓度,平衡发生移动,达到平衡态II
C.反应达到平衡I以后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态Il时浓度不相等。
第Ⅱ卷(非选择题共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com