
4.“可比克”薯片等膨化食品的包装袋内充有某种气体,是为了防止在贮运过程中将食品压碎。你认为该气体是
A.氧气 B.氯气 C.氮气 D.二氧化硫
3.食品检验是保证食品安全的重要措施,下列不属于食品安全检测指标的是
A.淀粉的含量 B.二氧化硫的含量
C.亚硝酸盐的含量 D.甲醛的含量
2.三聚氰胺是一种重要的有机合成原料,但不是食品添加剂,其化学式是C3H6N6,该物质跟水反应的最终产物是三聚氰酸,其化学式是C3H3N3O3。由三聚氰胺转化为三聚氰酸,氮元素的质量分数
A.变大 B.变小 C.不变 D.无法确定
1.2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。下列说法不正确的是
A.在生活舱中,可用过氧化钠制备氧气
B.金属镁可用作制造飞机、火箭的重要材料
C.在航天试验用的仪器仪表中大量使用了硅等非金属材料
D.返回舱外层的隔热瓦使用的是金属材料
2008年,我国的三鹿奶粉事件警示人们要关注食品安全。请回答与食品有关的2-5小题。
27.(18分)聚合硫酸铁(PPS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料制取聚合硫酸铁,为控制水解时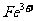 的浓度,防止生成
的浓度,防止生成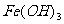 ,原料中的
,原料中的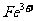 必须先还原为
必须先还原为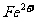 。实验步骤如下:
。实验步骤如下:
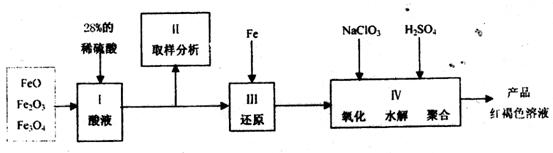
(1)步骤II取样分析溶液中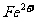 、
、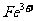 的含量,其目的是
。
的含量,其目的是
。
(2)步骤III完成后溶液中的金属阳离子是 ,可用 试剂检验其存在。
(3)用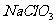 氧化时反应如下,请配平该化学方程式:
氧化时反应如下,请配平该化学方程式:
□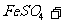 □
□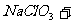 □
□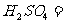 □
□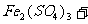 □
□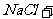 □
□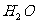
若改用硝酸作氧化剂,有何弊端: 。
(4)聚合硫酸铁溶液中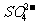 与
与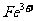 物质的量之比可根据下列提供的试剂和操作方法进行测定,请按要求回答下列问题:
物质的量之比可根据下列提供的试剂和操作方法进行测定,请按要求回答下列问题:
① 所需的试剂是(填选项字母,下同) 。
A. 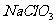 溶液 B.
溶液 B.
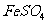 溶液
溶液
C. 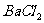 溶液 D.
溶液 D.
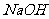 溶液
溶液
② 需要测定其质量的物质化学式是 。
③ 按顺序分别写出测定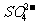 与
与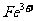 物质的量之比的过程中涉及的基本操作:
物质的量之比的过程中涉及的基本操作:
; 。
A. 萃取、分馏 B. 冷却、称重
C. 蒸发、结晶 D. 过滤、洗涤
E. 添加试剂、充分搅拌 F. 灼烧
G. 烘干
选考题(每科选做1题)
26.(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C常温下为无色液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作干电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
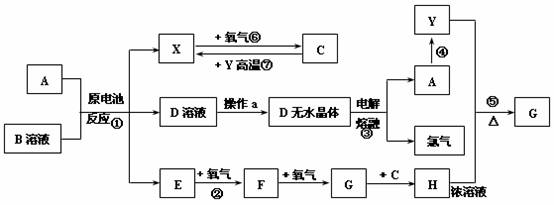
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应①的离子方程式为 。
(5)原电池反应①中正极的电极反应式为 。
25.(15分)
I.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
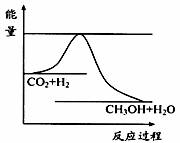
(1)关于该反应的下列说法中,正确的是_______。
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为_______________。
(3)温度降低,平衡常数K______ ___(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。
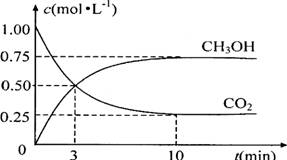
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有______。
A.升高温度; B.加入催化剂; C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2; E.充入He(g),使体系总压强增大。
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12该温度下水的离子积Kw=_______;t______25℃(填“大于”、“小于”或“等于”)。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
|
序号 |
NaOH溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
20.00 |
0.00 |
8 |
|
② |
20.00 |
20.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为_______ 。
13.相同条件下,向100mL pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46g Na,产生氢气的体积分数为V1、V2、V3,则下列关系中,正确的是 ( )
A.V3<V2<V1 B.V1=V2=V3 C.V1=V3>V2 D.V1=V3<V2
12.下列叙述不正确的是 ( )
A.在0.1mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
B.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,
c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.CH3COOH和CH3COONa的混合溶液中,若c(CH3COO-)大于c(Na+),则溶液显酸性
D.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
11.用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 .. ( )
①将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
②实验过程中取出盐桥,原电池仍继续工作
③正极反应为:Ag++e-=Ag
④在外电路中,电流由铜电极流向银电极
A.①② B.②③ C.③④ D.①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com