
21.(12分)钡化合物产品主要用于玻璃、医药、塑料、炸药等工业。工业上制备BaCl2的工艺流程图如下:
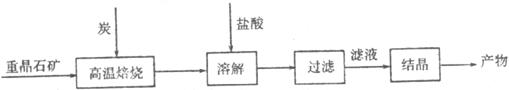
某研究性学习小组在实验室用重晶石矿(主要成分BaSO4)对上述工业过程进行模拟实验。实验中查阅资料得:
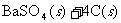

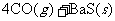
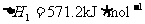 ①
①
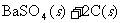

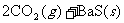
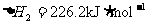 ②
②
(1)反应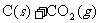

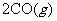 的
的 。
。
(2)将高温焙烧后产生的气体用一定量的NaOH溶液完全吸收,得到只含等物质的量的两种盐溶液,溶液中各离子的浓度由大到小的顺序为__________。
(3)医疗上,用硫酸钡做内服造影剂,而不用碳酸钡。请用离子方程式表示碳酸钡不能用作钡餐的原因:______________________________。
(4)已知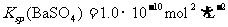 。现一患者误食BaCl2中毒,需用大量的Na2SO4稀溶液洗胃。若医生选用
。现一患者误食BaCl2中毒,需用大量的Na2SO4稀溶液洗胃。若医生选用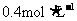 的Na2SO4溶液,当反应达到BaSO4的溶解平衡后,
的Na2SO4溶液,当反应达到BaSO4的溶解平衡后,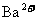 的物质的量浓度为____________________。要配制该溶液,现有56.8gNa2SO4固体,需要水__________g(假设
的物质的量浓度为____________________。要配制该溶液,现有56.8gNa2SO4固体,需要水__________g(假设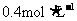 的Na2SO4溶液的密度为
的Na2SO4溶液的密度为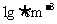 )。
)。
20.(10分)如下图所示装置,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,开始实验前,两玻璃管(Ⅰ、Ⅱ)中盛满氢氧化钠溶液,且S1,S2均断开。先接通S1,两玻璃管中有气体生成(假设气体未逸出装置)。一段时间后(两玻璃管中液面未脱离电极),再断开S1,接通S2,电流表 的指针发生偏转。请回答:
的指针发生偏转。请回答:
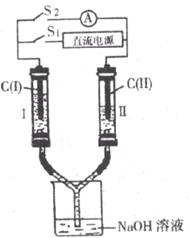
(1)接通S1后C(Ⅰ)的电极反应式是____________________,Ⅰ、Ⅱ两管中产生气体的质量之比是__________。
(2)断开S1,接通S2,C(Ⅱ)的电极反应式是___________________________。
(3)将溶液改为硫酸铜溶液,接通S1,断开S2,写出电解反应的化学方程式__________ ______________________________。
(4)利用该装置对粗铜进行电解精炼,则电极材料C(Ⅰ)改为________________。
19.(10分)哈伯因发明工业合成氨的方法获得了1918年诺贝尔化学奖。已知合成氨反应为: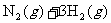

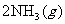 N
N 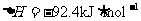 。试回答下列问题:
。试回答下列问题:
(1)现代合成氨工业中采取的下列措施,可用化学平衡移动规律解释的是________(填序号)。
A.采用较高压强(20MPa-50MPa)
B.采用高温(500℃)
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
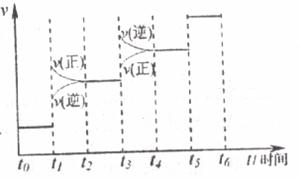
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH2的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是________ __________________________________________。过程中表示平衡混合物中NH3的含量最高的一段时间是__________。
(3)在一定温度下,将2 mol N2和6mol H2混合气体充入一容积不变的2L密闭容器中,保持温度不变,反应达到平衡时,容器中氨气的物质的量为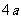 mol,则平衡常数
mol,则平衡常数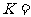 ____________________(用含
____________________(用含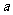 的代数式表示)。
的代数式表示)。
(4)若改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________(选填顺序编号)。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
18.(16分)常温下有浓度均为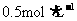 的下列溶液:①碳酸钠溶液,②碳酸氢钠溶液,③盐酸,④氨水,⑤硫酸氢钠溶液,⑥硫酸铝溶液,⑦醋酸溶液。请根据题目要求回答下列问题:
的下列溶液:①碳酸钠溶液,②碳酸氢钠溶液,③盐酸,④氨水,⑤硫酸氢钠溶液,⑥硫酸铝溶液,⑦醋酸溶液。请根据题目要求回答下列问题:
(1)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是__________(填序号,下同);可发生水解反应的是___________,在发生水解反应的溶液中pH最大的是___________。
(2)在泡沫灭火器中使用的药品是___________(填序号),发生反应的离子方程式是_________________________________。
(3)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的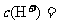 ________。
________。
(4)取适量溶液④,加入少量氯化铵固体,此时溶液中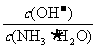 的值__________(填“增大”或“减小”或“不变”);原因是______________________________。
的值__________(填“增大”或“减小”或“不变”);原因是______________________________。
17.(12分)化肥是重要的农业生产资料。某化肥的有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,甲同学设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸、氢氧化钠溶液反应):
①配制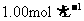 的HCl溶液和
的HCl溶液和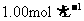 的NaOH溶液;
的NaOH溶液;
②称取1.00g此化肥样品,溶于20mL蒸馏水中;
③在②中加入35.00mL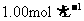 的NaOH溶液,并加热煮沸,冷却至常温,把该溶液全部转移到锥形瓶中;
的NaOH溶液,并加热煮沸,冷却至常温,把该溶液全部转移到锥形瓶中;
④以酚酞为指示剂,用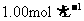 的HCl溶液滴定,滴定开始时读数为V1,终点时读数为V2(如下图所示);
的HCl溶液滴定,滴定开始时读数为V1,终点时读数为V2(如下图所示);
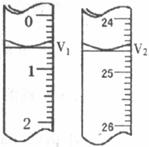
⑤根据实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)步骤①中,配制盐酸和氢氧化钠溶液都能用到的仪器是___________。
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗 E.容量瓶
(2)步骤③中反应的离子方程式是:_________________________________。
(3)步骤④中,V2=___________mL;甲同学求得的该化肥样品中氮元素的质量分数为___________。
(4)乙同学认为应重复②③④步操作1-2次,你认为这样做的目的是______________。
(5)实验过程中,下列操作会造成实验结果(氮元素的质量分数)偏低的是_________。
A.酸式滴定管未润洗就装标准液滴定
B.锥形瓶未用待测液润洗
C.读取盐酸读数时,滴前仰视,滴定到终点后俯视
D.滴定前酸式滴定管尖嘴处有气泡未排除,滴定后气泡消失
16.强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
A.1︰1 B.2︰1 C.1︰10 D.10︰1
第Ⅱ卷(非选择题 60分)
15.下列各溶液中,微粒的物质的量浓度关系正确的是
A.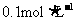 NH4C1溶液:
NH4C1溶液: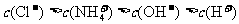
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
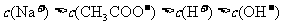
C.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液: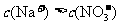
D.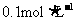 Na2CO3溶液:
Na2CO3溶液: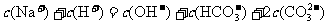
14.LiFePO4新型锂离子动力电池是绿色能源的新宠。已知该电池放电时的电极反应式为:正极 ,负极
,负极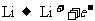 ,下列说法中正确的是
,下列说法中正确的是
A.充电时电池反应为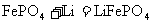
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部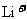 向负极移动
向负极移动
D.放电时,在正极上是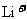 得电子被还原
得电子被还原
13.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为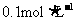 ,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
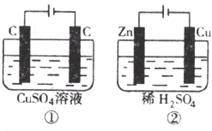
A.两溶液的pH都增大
B.两溶液的pH都减小
C.溶液的pH变化:①减小,②增大
D.电极反应式:①中阳极: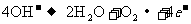
②中负极: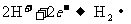
12.某研究小组研究了其他条件不变时,改变某一条件对以下可逆反应的影响:
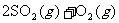

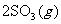
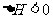 ;下列说法正确的是
;下列说法正确的是
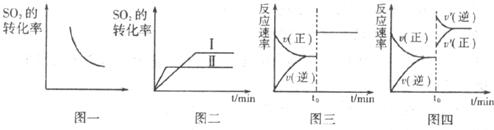
A.图一研究的是压强对平衡的影响,横坐标表示压强
B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高
C.图三中t0时使用了催化剂,使平衡向正反应方向移动
D.图四中t0时增大压强,使平衡向正反应方向移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com