
2.下列物质属于电解质,且与水反应的产物中含非极性分子的是 ( )
A.NH4C1 B.Na2O2 C.Na2S D.CO2
1.下列化合物中阴离子半径和阳离子半径之比最大的是 ( )
A.LiI B.NaBr C.KC1 D.CsF
31.现有一包铝粉和氧化铁粉末的混合物,在高温下使之充分反应。
(1)该反应的一种主要用途是___________________
(2)将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
(a)向其中一份固体中加入100mL2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
(b)向另一份固体中加入140 mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
①计算这包铝热剂中铝的质量和氧化铁的质量:m(Al)=___________,m(Fe2O3)=___________
②计算实验②产生气体的体积(标准状况):V=________________L
(3)某铝和氧化铁混合粉末15.0g 在高温下充分反应,冷却碾细后,与不同体积4.0mol/L的盐酸作用时,产生气体的体积如下表所示:
|
实验编号 |
混合粉末的质量(g) |
加入盐酸的体积(mL) |
产生气体的体积(L,S、T、P) |
|
A |
15.0 |
100 |
4.480 |
|
B |
15.0 |
120 |
5.376 |
|
C |
15.0 |
140 |
5.376 |
由表中数据,通过计算确定该混合粉末中铝粉和氧化铁粉末的物质的量之比。
30.将一块生锈铁片置于200mL稀HNO3中,反应结束后收集到1.12 L NO(标准状况),溶液中还剩下3 g单质铁。取出铁后,向溶液中通入10.65 g Cl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+ 反应)。
求(1)这块生锈铁片中未被氧化的铁的质量。(2)原硝酸的物质的量浓度? (铁锈的成分为Fe2O3•H2O)
29.近年来,我国科学家对有机物的“自由基”的研究有新的突破,在国际上占有领先的地位。有机物中常见的最简单的自由基是碳烯(:CH2),它十分活泼,很容易用它的两个未成对电子与不饱和烃反应,生成三碳环;也可以插在烷基的碳氢键(C-H)之间,使碳链增长。请回答下列问题:
(1)写出碳烯的电子式
(2)写出碳烯与丙烯反应产物的结构简式
(3)碳烯与烃A反应,生成烃B,一定量的B完全燃烧生成8.8g CO2和4.5g H2O,B分子中含有3个-CH3,且能完成下列转化关系:
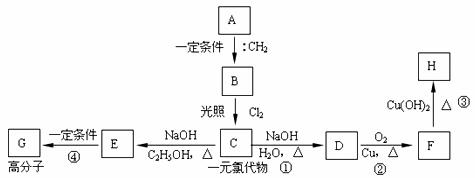
①写出A的结构简式 ,反应①的类型 ;
②写出反应②④的化学方程式: 反应② ; 反应④ 。
③H的同分异构体有多种,请写出能与NaOH溶液反应,但不与NaHCO3反应的同分异构体的结构简式 。
28.2008年9月11日,某婴幼儿奶粉因非法加入化工原料,导致数千名儿童患肾结石。据质监部门调查,这种毒奶粉过量添加了一种被称为三聚氰胺的化学物质。由于食品和饲料工业蛋白质含量测试方法的缺陷,三聚氰胺常被不法商人用作食品添加剂,以提升食品检测中的蛋白质含量指标,因此三聚氰胺也常被称为“蛋白精”。 三聚氰胺由氰胺(NH2-C≡N)聚合而成
(1)写出三聚氰胺的分子式________,奶粉中的蛋白质主要由氨基酸组成,蛋白质的平均含氮量一般为17%左右,而三聚氰胺的含氮量则高达______,因此被为不法商人所青睐。
(2)已知:3HC≡CH→ 且三聚氰胺的结构高度对称,试画出三聚氰胺的结构简式____________
且三聚氰胺的结构高度对称,试画出三聚氰胺的结构简式____________
(3)三聚氰胺最早被李比希于1834年合成,早期合成使用双氰胺法:由电石(CaC2)制备氰胺化钙(CaCN2),氰胺化钙水解后二聚生成双氰胺,再加热分解制备三聚氰胺。试写出由电石和某种单质反应制备氰胺化钙(CaCN2)的化学方程式___________________
(4)三聚氰胺导致结石的机理目前尚无定论,有研究表明可能是由于三聚氰胺会在胃的强酸性环境中水解,胺基逐步被羟基取代,先生成三聚氰酸二酰胺,进一步水解生成三聚氰酸一酰胺,最后生成三聚氰酸,三聚氰酸随后在肠道内被吸收,从而进入血液,在血液中三聚氰酸能够和钙离子结合形成不溶解的三聚氰酸钙,肾脏在过滤血液杂质的时候三聚氰酸钙就会在肾脏聚集最终形成结石。试写出三聚氰胺水解的化学方程式____________________。
27.物质分析的方法通常有重量法、容量法(滴定法)、气体体积法。粉笔由白垩(碳酸钙)制成。为增加硬度,还掺入了适量硫酸钙。某学习小组为测定粉笔中碳酸钙的质量分数,设计了以下实验。
方案一、重量法
将粉笔研细,加强热,使其发生分解反应:CaCO3 CaO+CO2↑
CaO+CO2↑
(1)加热后,须待冷却后才能称量,应在______________中(填仪器名称)冷却。
(2)若粉笔反应前质量为m1 g,加热至恒重后质量为m2 g,则CaCO3的质量分数为________
(3)该小组的同学经过思考,认为要使实验可靠,还需查阅几个数据,这些数据包括(请填写其中两个)___________________
方案二、滴定法
称取1.200g研细的粉笔,加入过量的30.00mL 浓度为1.000mol/L的盐酸,再加2滴酚酞,用1.000mol/L的NaOH溶液滴定。
(4)该实验要用到下列仪器中的_______________
a.电子天平 b.托盘天平 c.滴定管 d.量筒
(5)若到滴定终点时消耗NaOH溶液10.00mL,则粉笔中CaCO3的质量分数为__________%
(6)某同学做了3次平行实验,耗用的NaOH溶液的体积基本相同,可是测得的CaCO3的质量分数都比其他同学高,可能的原因是___________________________(写出其中一点)
(7)你认为以上两种方案中较好的是_____________
26.某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。
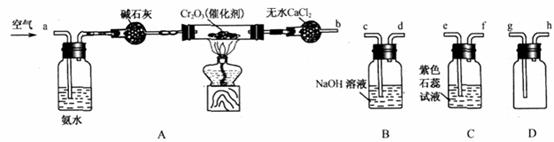
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_________;D中的现象是_______________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通入空气,再加热A装置中的催化剂
c.在由导管a通入空气的同时,加热A装置中的催化剂
25.在一容积为10 L的密闭容器中加入3 mol H2和1 mol N2,在一定条件下发生如下反应:N2(g) + 3H2(g)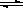 2NH3(g) + Q(Q>0),反应至20 min时,容器内各物质的浓度不再发生变化,此时测得H2为2.4 mol。
2NH3(g) + Q(Q>0),反应至20 min时,容器内各物质的浓度不再发生变化,此时测得H2为2.4 mol。
(1)反应开始至达到化学平衡时的平均反应速率v(NH3)为_______________mol/(L·min)。
(2)反应达到平衡后,使某一条件发生变化,如下图所示的(1)-(5)各曲线中,符合勒沙特列原理的是_________(填曲线编号)。
|
|
(3)反应达到平衡后,若降低温度,正反应速率__________(填“增大”、“减小”或“不变”,下同),逆反应速率__________,化学平衡常数K___________。
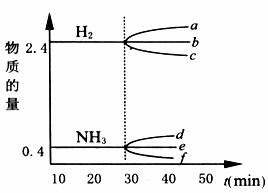
(4)反应达到平衡后,若增大压强,H2的物质的量变化正确的是_______(用下图中a-c的编号回答);若加入铁触媒,则NH3的物质的量变化正确的是_______(用下图中d-f的编号回答)。
24.(1)-5℃时,高氙酸钠(Na4XeO6)能跟浓硫酸反应生成XeO4气体。XeO4极不稳定,固体XeO4在-40℃也可能发生爆炸生成氙气和氧气。请分别写出两个反应的化学方程式: ;
(2)Xe的原子序数为54,Xe核外M层和N层的电子数分别为 和 。
(3)高氙酸钠(Na4XeO6)用于分解锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn2+氧化为MnO4-,生成XeO3 。高氙酸钠在水溶液中已发生如下反应:Na4XeO6+H2O=NaOH+Na3HXeO6 ,请写出高氙酸钠溶液和硫酸锰的硫酸水溶液反应的离子反应方程式: ,若有1mol Na4XeO6参加反应,转移的电子为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com