
8.以下实验或操作不能达到目的的是 ( )
A.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
B.用溴水鉴别苯、乙醇、四氯化碳
C.用滴定管量取8.00mL的2mol/L NaCl溶液
D.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁
7.下列事实与胶体性质无关的是 ( )
①在豆浆里加入盐卤做豆腐;
②牛油与烧碱溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出;
③一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路;
④三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀;
⑤肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗;
⑥水泥、冶金厂常用高压电除去工厂烟尘,以减少对空气污染。
A.②④ B.④ C.③⑤ D.①⑥
6.国家提出经济发展要“又好又快”,要“环境友好和可持续发展” 。下列行为违背这一主题的是 ( )
A.将煤液化或气化并对产品进行综合利用
B.以植物秸秆为原料制生物柴油
C.在高速公路路面大范围地使用融雪剂
D.以“设计绿色化工工艺,提高原子利用率”为目标进行产业换代
26.(8分)某结晶水合物含有两种阴离子和一种阴离子,称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向第一份逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐增多,当沉淀量达到最大时,继续滴加NaOH溶液,加热后有气体逸出,该气体能使湿润的红色石蕊试纸变蓝,共收集到该气体2.24L(标准状况下);继续滴加NaOH溶液,白色沉淀逐渐减少并最终消失。向第二份逐滴加入Ba(OH)2溶液,过滤后向沉淀中加入足量的稀盐酸,最终得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是______和_______,阴离子是______ ;
(2)试通过计算确定该结晶水合物的化学式。
25.(12分)某研究性学习小组的同学查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2 + CaCl2 + 2H2SO4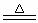 2CaSO4
+ 2Cl2↑ + 2H2O,他们设计了如下图制取氯气并验证其性质的实验装置:
2CaSO4
+ 2Cl2↑ + 2H2O,他们设计了如下图制取氯气并验证其性质的实验装置:
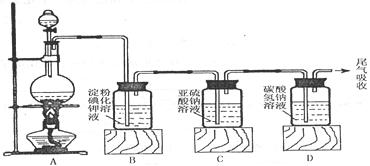
(1)简述检查装置A气密性的方法: ;
(2)硫酸在反应中表现出来的性质是 (填序号)
① 只有还原性 ② 只有氧化性 ③ 只有酸性 ④ 酸性和还原性
(3)B装置中发生反应的化学方程式为 ; D装置中发生反应的化学方程式为 ;
(4)请你帮该小组同学设计一个实验,证明C中的Na2SO3已被氧化(简述实验步骤):
(5)尾气成分为 。
24.(10分)A~J分别表示中学中常见的物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为某主族元素的氧化物,A、B、C、D、E、F六种物质中 均含同一种元素。请回答:
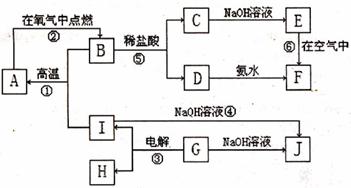
(1)A、B、C、D、E、F六种物质中,所含的相同元素位于周期表中的第 周期 族;
(2)反应①的化学方程式为 ;
(3)反应④的化学方程式为 ;
(4)E在空气中转化为F的现象为 ;
(5)反应①、②和③中,属于放热反应的是 (填序号)。
23.(10分)X、Y、Z、W四种短周期元素,原子序数依次递增,X原子形成的阳离子是一个质子,Y原子的最外层电子数是其次外层电子数的2倍,Z原子的最外层电子数与Y
|
请回答:
(1)甲的化学式为 ,乙的化学式为 ;
(2)W2Z的晶体类型为 晶体。X和Z形成X2Z的过程可用电子式表示为 ;
(3)将3gY的单质在足量Z的单质中燃烧,所得气体通入1L0.4 mol·L-1甲溶液中, 完全吸收后,溶液中的溶质及其物质的量分别为 ;溶液中所含离子的物质的量浓度由大到小的顺序为 ;
22.(10分)在一密闭容器中发生反应N2+3H2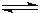 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应进程的关系如图所示:
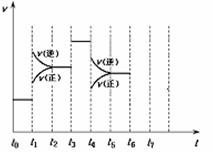
回答下列问题:
(1)处于平衡状态的时间段是 (填选项);
A.t0-t1 B.t1-t2 C.t2-t3 D.t3-t4 E.t4-t5 F.t5-t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项)
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 ;
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项);
A.t0-t1 B.t2-t3 C.t3-t4 D.t5-t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化情况;
(5)一定条件下,合成氨反应达到平衡时,测得反应混合气中氨气的体积分数为20%, 则反应后与反应前的混合气体体积之比为 。
21.(10分)某反应的化学方程式如下(未配平):
NO+O2+NO2+H2O--HNO3
(1)反应中的还原剂是 ;
(2)如果参加反应的氧气中有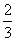 被NO还原,则NO与NO2的物质的量之比为 , 配平该条件下的化学方程式,并用单线桥法标出电子转移的方向和数目;
被NO还原,则NO与NO2的物质的量之比为 , 配平该条件下的化学方程式,并用单线桥法标出电子转移的方向和数目;
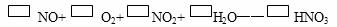
(3)上述反应的化学计量数有多种组合,NO、O2、NO2的化学计量数至比可以为______________(填选项)。
A.3:4:2 B.1:1:1 C.4:9:24
20.某CaCl2样品中混有FeCl3、MgCl2、NaCl和Na2CO3中的一种或几种杂质。取11.1g样品溶液,得无色溶液,再加入足量AgNO3溶液,得到29.7g沉淀。则样品中 ( )
A.一定无Na2CO3,可能有FeCl3 B.一定有MgCl2,没有NaCl
C.一定有MgCl2,可能有Na2CO3 D.一定有MgCl2,可能有NaCl
第Ⅱ卷(非选择题,共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com