
30.(13分)
下图中A、B、C、D、E、F、G、H均为有机化合物。
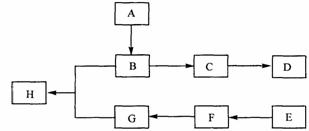
回答下列问题:
(1)有机化合物 A的相对分子质量小于60,A能发生银镜反应,1molA在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是_________,由A生成B的反应类型是________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是_____________ ;
(3)①芳香化合物E的分于式是C8H8Cl2。E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式是_______________________________
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)。1 mol G与足量的 NaHCO3溶液反应可放出 44.8 L CO2(标准状况),由此确定E的结构简式_________
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是___________,该反应的反应类型是_________________。
25.(15分)在一定温度和催化剂下,将4 mol H2和1 mol N2在混合于一个容积为2L的密闭容器中,发生以下反应:N2(g)+3H2(g) 2NH3(g));△H=-92.4kJ·mol-1,在2min末生成了1.6molNH3。
2NH3(g));△H=-92.4kJ·mol-1,在2min末生成了1.6molNH3。
(1)在2min内以N2表示的反应速率为 ;此时H2的转化率为
(2)升高温度,H2的转化率 (填“增大”.“减小”.“不变”)。
(3)保持温度和压强不变,充入少量稀有气体,则NH3的物质的量 (填“增大”、“减小”、“不变”)。
(4)若上述反应在相同条件下从逆反应开始进行,开始时加入0.4 molN2和1.2 molNH3,若要使平衡时各物质的质量分数与原来平衡完全相同,则还应该加入H2的物质的量为
(5)将一定量的氨气通入盐酸中,溶液pH恰好为13 (25℃)则该溶液的溶质为_______ ,请推测其离子浓度大小顺序_____________
[选做部分]
24.(15分)某碳氢化合物A的结构简式为
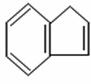
(1)A的分子式是_____________________
(2)若A的同分异构体B中含有苯环和碳碳三键,则B 的结构简式有_____种
(3)已知多个羟基连在同一个C上不稳定,易自动失水: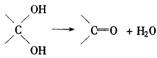
若B的一种同分异构体X中含有-CH2- ,X能发生如下图所示的转化关系。
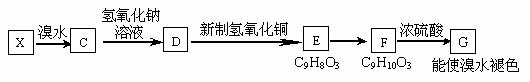
①指出反应类型E→F是_________________,F→G是_____________________
②写出D→E的化学方程式_____________________________________________
③已知G可用于制备高聚物(离子交换树脂),请写出在一定条件下制备该高聚物的化学方程式________________________________________________
23.(15分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:
① 将干燥的氯气在110℃ - 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
|
S |
112.8 |
444.6 |
略 |
|
S2C12 |
-77 |
137 |
遇水生成HCl、SO2、S; 300℃以上完全分解; S2C12 + C12  2SCl2 2SCl2 |
设计实验装置图如下:
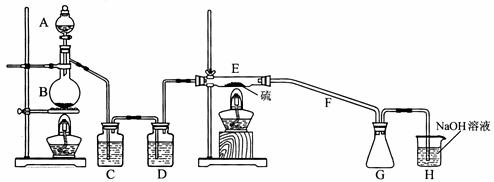
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见___________利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:_______________;E中反应的化学方程式:_______________。
(3)C、D中的试剂分别是_______________、_________________。
(4)如果在加热E时温度过高,对实验结果的影响是
在F中可能出现的现象是______________ ;
(5)S2C12粗品中可能混有的杂质是(填写两种)______________、________________,
为了提高S2C12的纯度,关键的操作是控制好温度和 。
12.下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的M(OH)2溶液任意比混合:
c(H+) + c(M2+) == c(OH-) + c(A-)
B.pH相等的CH3COONa.NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
第II卷(必做+选做)
[必做部分]
11.用下列实验装置进行的实验,能达到相应实验目的的是
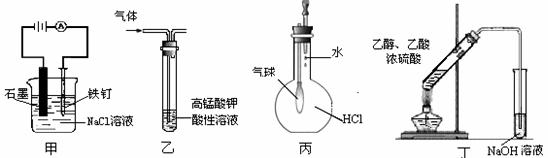
A.装置甲:防止铁钉生锈 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:验证HCl气体在水中的溶解性 D.装置丁:实验室制取乙酸乙酯
10. 不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600℃~700℃。已知该电池的总反应为2H2+O2==2H2O;负极反应为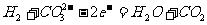 ,则下列推断正确的是
,则下列推断正确的是
A.正极反应为: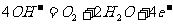 B.放电时
B.放电时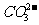 向负极移动
向负极移动
C.电池供应1mol水蒸气,转移的电子数为4mol D.放电时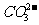 向正极移动
向正极移动
9.下列离子方程式书写正确的是
A.铁跟盐酸反应: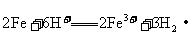
B.碳酸氢钙溶液跟过量的氢氧化钠溶液反应: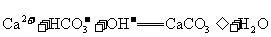
C.次氯酸钙溶液中通入过量的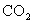 :
: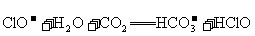
D.氯化铝溶液与过量的氨水反应: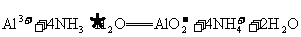
8.用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,2.24L的苯中含有0.3 NA个碳碳双键
B.120gNaHSO4晶体中所含的离子总数为3NA
C.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.VLamoL/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA
7. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度.高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。下列说法正确的是
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度.高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。下列说法正确的是
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于第ⅢA族,可推知氮化镓化学式为Ga3N2
C.工业上可用金属铝与V2O5在常温下冶炼钒,铝作还原剂
D.ETFE膜(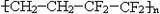 )是一种可焊接的塑料
)是一种可焊接的塑料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com