
6.下列关于化学观或化学研究方法的叙述中,错误的是 ( )
( )
A.在化工生产中应遵循“绿色化学”的思想
B.控制实验条件可以改变化学反应的限度和速率
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由HCIO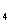 可以类推出氟元素也存在最高价氧化物的水化物HFO
可以类推出氟元素也存在最高价氧化物的水化物HFO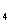

29.(11分)
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的被铁药品,下表是说明书的部分内容。
|
[规格] 每片含琥珀酸亚铁0.1g [适应症] 用于缺铁性贫血症,预防及治疗用。 [用量用法] 成人预防量0.1g/日,成人治疗量0.2g-0.4g/日, 小儿用量预防量30-60mg/日,治疗量0.1g-0.3g/日。 [贮藏] 避光、密封、在干燥处保存 |
(1)该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 ___________ (填试剂的名称)
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应)。请配平下列离子方程式
______MnO4- + ______Fe2+ + ______H+== ______Mn2+ + ______Fe3+ + ______H2O
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00 g,将其全部溶于稀硫酸中,配制成1000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗?__________(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)_______ 。
(2)已知琥珀酸为二元有机酸。含23.6 g琥珀酸的溶液与4mol/L100mL的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式) 。
28.(12分)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
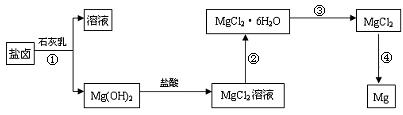
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是 。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、
(填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:
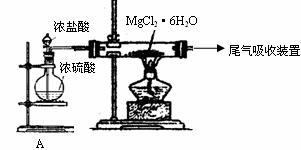
装置A由分液漏斗、 、铁架台(带铁圈)、石棉网、双孔塞和导管组成,该实验装置在过程③中的作用是 。
27.(14分)有机物A(C11H12O2)可调配果味香精。用含碳、氢、氧三种元素的有机物B和C为原料合成A。
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3。有机物B的分子式为 。
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使Br2的CCl4溶液褪色。C的结构简式为 。
(3)已知两个醛分子间能发生如下反应:
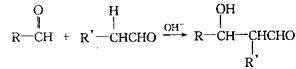
(-R、-R′表示氢原子或烃基)
用B和C为原料按如下路合成A:
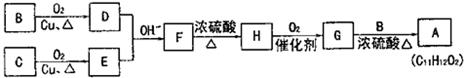
|
①上述合成过程中涉及的反应类型有: 。(填写序号)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应 e.还原反应
②B转化成D的化学方程式为: 。
③G和B反应生成A的化学方程式为 。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式: 。
26.(10分)
下图中,A为气体非金属单质,N、P是金属单质;N可以在CO2中燃烧,P是日常生活中最常见的金属,D是空气中含量最多的气体;B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,Z为液体;C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
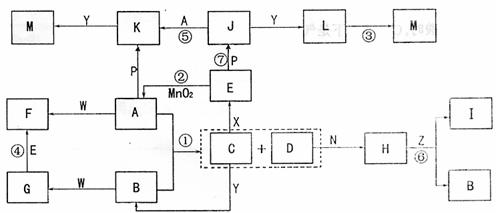
请按要求回答:(1)写出D的结构式 ,F的化学式 ;
(2)反应③的化学方程式为 ;
(3)反应②的离子方程式为 ;
(4)由J制取L时反应的环境要求是 。
25.(14分)现有A、B、C、D、E、F六种原子序数依次增大的前四周期主族元素,且分属四个周期。A、E同主族;B、C、D为同周期相邻的三种元素;B元素形成的化合物种数是所有元素中最多的;D、E简单离子具有相同的电子层结构;F与B可形成FB2型离子化合物。请填写下列空白:
(1)D与E按原子个数比1:1形成的化合物的电子式为 、 。
(2)B可形成多种同素异形体,其中一种同素异形体熔、沸点很高,硬度大,该同素异形体的晶体类型为 ,含有1mol B原子的该晶体中含有的共价键的数目为 。
(3)由A、B、D、F四种元素组成的化合物与过量的E的最高价氧化物对应水化物反应的离子方程式为 。
(4)C与E形成的一种化合物中,E元素的质量分数为35.4%,该化合物的摩尔质量不超过70g/mol,则该化合物的化学式为 ,其中可能含有的化学键类型为 。已知该化合物在水中可以发生水解,其水解的离子方程式为 。
24.(10分)
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是:
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼-空气燃料电池放电时,正极的电极反应式是 ;负极的电极反应式是 。
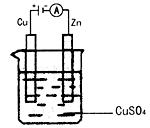
(3)如图是一个电化学过程示意图。假设使用肼-空气燃料电池作为本过程的电源,铜片质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是
。
23.(8分)在一定条件下,N2和H2发生如下反应:
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol
(1)该反应中△H的含义是(填序号): 。
①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,N2与H2反应生成2molNH3时放出的热量
④该条件下,N2与H2反应生成2molNH3时吸收的热量
(2)达到平衡后,在其他条件不变的情况下降低温度,H2的转化率________________,化学反应速率_______________(填“增大”、“减小”或“不变”)。
(3)在甲、乙两个容积相等且固定的密闭容器中分别充入1mol N2、3molH2和2molN2、6molH2。平衡后,两容器内放出的热量分别记作Q甲和Q乙,Q甲和Q乙的关系是 。
A.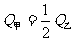 B.
B.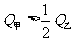
C.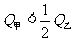 D.无法确定
D.无法确定
21.1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入O2的体积是 ( )
A.336mL B.224mL C.168mL D.504mL
|
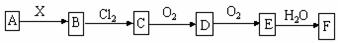
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
第Ⅱ卷(非选择题,共79分)
20.甲、乙两烧杯中分别盛有100mL浓度均为3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体的体积之比为3:4,则加入铝粉的质量为 ( )
A.5.4g B.3.6g C.2.7g D.1.8g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com