
27.(18分)(1)恒温、恒压(1.01×105Pa)下,将2.0molSO2与a molO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
①T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a= ;平衡时SO2的转化率为 。
②T2℃下反应达平衡时,混合气体的物质的量共为4.8mol。T1与T2的关系是: (选填序号)。
A.T1>T2 B.T1<T2 C.T1=T2
(2)X、Y、Z为前三周期元素形成的微粒,它们的电子总数相等。已知X为负二价双原子阴离子;Y为双原子分子;Z常温为液体,其水溶液呈弱酸性。
①X与钠离子组成的离子化合物常温下跟水反应产生一种可助燃的气体,该反应的化学方程式为: 。
②若Y为遇水就能剧烈反应的单质,则Y的电子式为 ;若Y为化合物,用石墨电极电解Y的水溶液,其最初的电解反应为:_____________。
26.(12分)有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3。试填写下列空格:
2SO3。试填写下列空格:
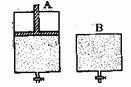
(1)两容器达到平衡时所需时间tA_____tB(填“>”“<”“=”);平衡时A容器中SO2的转化率比B容器_______;
(2)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
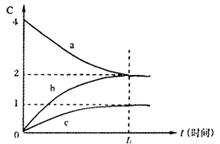
13.800℃时,a、b、c三种气态物质的浓度随着时间的变化情况如下图所示。由图分析不能得出的结论是
|
B.t1后,若升高温度,正、逆反应速率增大
C.t1后,若升高温度,a的转化率增大
D.t1后,若增大压强,混合气体的平均相对分子质量增大
12.X、Y、Z三者均为短周期元素,已知X元素有一种同位素不含中子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素原子的最外层电子数是次外层电子数的3倍。下列化学式①XYZ3、②X2YZ2、③X2YZ3、④X2Y2Z2、⑤X2Y2Z4、⑥X4Y2Z2中,并非都存在的一组分子是
A.①② B.④⑥ C.③⑤ D.②④
11.下列叙述中正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除第一周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
10.可逆反应A(g)+B(g) 2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol
C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是
2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol
C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是
A.m = n B.m > n C.m = 2n D.m < n
9.第二周期的元素与氢元素所形成的常见分子或离子中,电子总数为10的有
A.6种以上 B.5种 C.4种 D.3种
8.在标准状况下,甲乙两容器分别盛有甲烷气体和氨气。已知它们所含原子数目相同,则甲乙两容器的体积比为
A.4︰3 B.5︰4 C.4︰5 D.1︰1
7.在溶液中加入中量Na2O2后仍能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
6.反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)(反应物的消耗速率或产物的生成速率)可表示为
A.υ(NH3)= 0.010mol/(L·S) B.υ(O2)= 0.001 mol/(L·S)
C.υ(NO)= 0.001 mol/(L·S) D.υ(H2O)= 0.045 mol/(L·S)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com