
9.现有乙酸和两种链状单烯烃的混合物,若其中氧的质量分数为a,则碳的质量分数是
A. 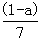 B.
B.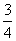 a C.
a C.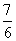 (1-a) D.
(1-a) D.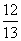 (1-a)
(1-a)
8.下列表示溶液中发生反应的化学方程式错误的是
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
7.将15mL、2mol·L-1Na2CO3溶液逐滴加入到40mLl0.5mol·L-1MCln盐溶液中,恰好将溶液中的Mn+离子沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
6.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+、NO-3、NH4+、Cl-
B.Ca2+、HCO3-、NH4+、AlO3-
C.K+、Ba2+、Cl-、HSO3-
D.Mg2+、NH4+、SO42-、K+
29.(14分)苄佐卡因是一种医用麻醉药口,学名对氨基因苯甲酸乙酯,它以对硝基甲苯为主要起因经下列反应制得:
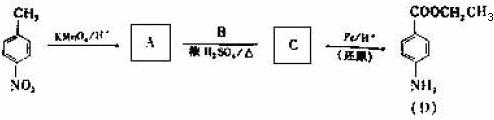
请回答下列问题:
(1)写出A、B、C的结构简式:A_____________、B______________、C______________。
(2)用1H核磁共振谱可以证明化合物C中有____________种氢处于不同的化学环境。
(3)写出同时符合下列要求的化合物C的所有同分异构体的结构简式(E、F、G除外)_______。
①化合物是1,4一二取代苯,其中苯环上的一个取代基是硝基
②分子中含有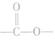 结构的基因
结构的基因
注:E、F、G结构如下:
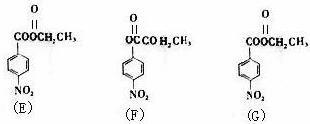
(4)E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式_____________。
(5)苄佐卡图(D)的水解反应如下:
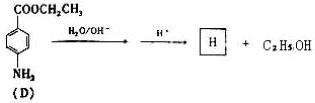
化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出它们所反应的化学方程式__________________。
28.(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氧氯化硅(反应温度450~500℃)四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
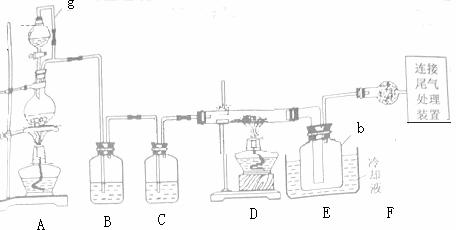
相关信息如下:
a.因氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氧化钠接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
① 滴定前是否滴加指示剂?____________(填“是”或“否”),请说明理由____________。
②某同学称取5.000g残留物后,经预处理后在容量中瓶中配制成100 mL溶液,在取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
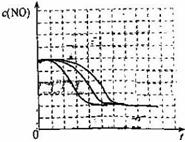
27.(15分)超音速飞机在平流层飞行时,尾报中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:
2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答:以下各题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速度v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是( )
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T/℃ |
NO初始浓度/ mol·L-1 |
CO初始浓度/ mol·L-1 |
催化剂的比表面积/ m2·g-1 |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
350 |
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
26.(14分)各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,①常用于制作印刷电路板。
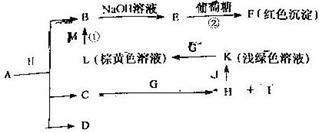
请回答下列问题:
(1)写出A的化学式 ,C的电子式 。
(2)比较Y与Z的原子半径大小 > (填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,举出该反应的一个应用实例 。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:
。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
13.下列说法正确的是
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用盐酸标准溶液滴定待测氢氧化钠溶液时,水洗后的酸式滴定管未经标准润洗,则测定结果偏低
非选择题部分
12.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电镀质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
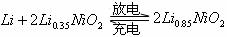
下列说法不正确的是
A.放电时,负极的电极反应式: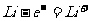
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com