
18.(4分)铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式 。某赤铁矿除了含Fe2O3之处,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是 。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。
你认为该方案合理吗?为什么? 。
(3)合成氨工业中所用的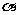 -Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:2 Fe2O3
+ C
-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:2 Fe2O3
+ C 4FeO+CO2↑。
4FeO+CO2↑。
实验教师提供了12g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为 g。
该小组设计了多个实验方案来测定所得产品是否符合要求。其中一个实验方案是用氢气还原加热的混合物,测定铁的质量分数。在用锌跟稀硫酸反应制取氢气时,该小组的同学向稀硫酸中加入少量硫酸铜溶液,目的是 。当混合物中铁的质量分数为 (用化简的分数表示)时,该产品合格。
17.(6分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
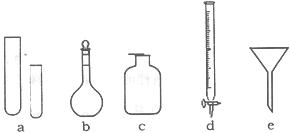
(1)指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则该空不需要填写。)
|
仪器编号 |
a |
b |
c |
d |
e |
|
名称 |
试管 |
容量瓶 |
集气瓶 |
碱式滴定管 |
普通漏斗 |
|
改正的名称 |
|
|
|
|
|
(2)关于e的用途,乙同学说:组成防倒装置。你还能说出其他两种用途吗?
① ;
② 。
(3)丙同学想用下图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。
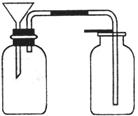
请你把该仪器画在图中合适的位置。
16.已知:H2O(g)=H2O(l) △H1=-Q1kJ·mol-1
CH3OH(g)=CH3OH(l) △H2=-Q2kJ·mol-1
2CH3OH(g)+3O2 = 2CO2(g)+4H2O(g) △H3=-Q3kJ·mol-1(Q1,Q2,Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ) ( )
A.Q1+Q2+Q3 B.0.5Q3-Q2+2Q1
C.0.5Q3+Q2-2Q1 D.0.5(Q1+Q2+Q3)
第Ⅱ卷(选择题,共40分)
[必做部分]
15.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g) Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B.其它条件不变,将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.其它条件不变,若增大压强,则物质Y的转化率减小
D.其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0
14.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是 ( )
A.H2Y的电离方程式:H2Y 2H++Y2-
2H++Y2-
B.该酸式盐溶液中粒子浓度关系:c(H+)+c(Na+)=c(OH-)+c(Y2-)+c(HY-)
C.该酸式盐溶液中粒子浓度关系:c(H+)+ c(H2Y) =c(OH-)+c(Y2-)
D.该酸式盐溶液中粒子浓度大小关系: c(Na+)> c(OH-)> c(H+)>c(HY-)
13.一些科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学化合氨的有关叙述正确的是 ( )
A.N2在阴极上被氧化
B.可选用铁作为阳极材料
C.负极的电极反应式是N2+6e-+6H+→2NH3
D.该过程的总反应式是N2+3H2 2NH3
2NH3
12.X、Y、Z、W均为短周期元素,它们有周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是 ( )
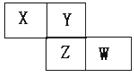
A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性W与Z弱
C.Z的单质与氢气反应较Y剧烈
D.X、Y形成的化合物都易溶于水
11.已知热化学方程式:2SO2(g)+O2(g) 2SO3(g) △H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )
2SO3(g) △H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )
A.相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量
B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化
9.下列离子方程式书写正确的是 ( )
A.NaClO溶液中通入少量的SO2气体:2ClO-+SO2+H2O = SO32-+2HClO
B.铜跟浓硝酸反应:3Cu+8H++2NO3-= 3Cu2++2NO↑+4H2O
C.向Ca(HCO3)2溶液中滴加过量NaOH溶液:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+ = BaSO4↓
|
A.1mol Cl2参加的任何反应,反应过程中转移电子数都是2NA
B.17g氨气所含的电子数为NA
C.46gNO2和N2O4混合气体中含有原子个数为3NA
D.标准状况下,11.2L乙醇所含分子数为0.5NA
8.用稀硫酸、氨水、氢氧化钠溶液中的任何一种作为试剂,均可鉴别的一组物质是( )
A.NaCl和Na2CO3 B.BaCl2和FeCl2
C.FeCl2和FeSO4
D.Al2(SO4)3和AlCl3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com