
24.磷化硼是一种有用的耐磨材料。它是由三溴化硼和三溴化磷在氢气气氛中,高温(>750℃)下制得的。这种陶瓷材料用作金属表面的防护薄膜。BP形成闪锌矿型(立方紧密堆积)结构。
(1) 写出生成BP的反应方程式。
(2) 画出三溴化硼和三溴化磷的路易斯结构式。
(3) 画出BP的晶胞图。
(4) 给出晶胞中BP的组成。
(5) 已知晶胞参数为a = 4.78Ǻ,试计算BP的密度(kg·m–3)。
(6) 计算硼原子与磷原子之间的最短距离。
23.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。
22.
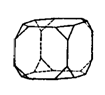 理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚MgO单晶如右图所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。
理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚MgO单晶如右图所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。
21.研究离子晶体,常考虑以一个离子为中心时,其周围不同距离的离子对它的吸引力或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则
(1) 第二层离子是 离子,有 个,它们离中心离子的距离为 d,。
(2) 已知在晶体中Na+离子的半径为116pm,Cl–离子的半径为167pm,
它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。
(3) 纳米材料的表面原子占原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
(4) 假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的10倍,试估算表面原子占总原子数的百分比。
20.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]–。
(1) 以上反应看起来很陌生,但反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是: 。
(2) 上述阴离子[CB11H6Cl6]–的结构可以跟图a的硼二十面体比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]–离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360˚/5的度数,不能察觉是否旋转过。请在图a右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。
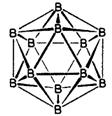

图a
19.固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。固体电解质取代液体电解质,可以做成全固态电池及其它传感器、探测器等,在电化学、分析化学等领域的应用日益广泛。
碘化银具有α、β和γ等多种晶型。在水溶液中Ag+与I-沉淀形成的是γ-AgI和β-AgI的混合物,升温至136℃全变为β-AgI,至146℃变为α-AgI。α-AgI是一种固体电解质,导电率为1.31Ω–1·cm–1(注:强电解质水溶液导电率为10–3-1Ω–1·cm–1)。
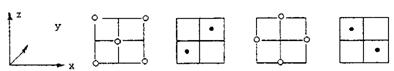
y = 0 y = 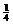 a y =
a y = 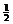 a y =
a y = 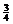 a
a
(1) γ-AgI和β-AgI晶体的导电性极差。其中γ-AgI晶体属立方晶体,其晶胞截面图如上所示。图中实心圆和空心圆分别表示Ag+和I-,a为晶胞边长。试指出和γ-AgI晶体的点阵型式和Ag+、I-各自的配位数(已知通常I-,Ag+的半径为100-150pm)。
(2) α-AgI晶体中,I-离子取体心立方堆积,Ag+填充在其空隙中。试指出α-AgI晶体的晶胞中,八面体空隙、四面体空隙各有多少?
(3) 通常Ag+离子半径有一个变化范围,为什么?
(4)  实验发现,α-AgI晶体中能够迁移的全是Ag+,试分析Ag+能够发生迁移的可能原因。
实验发现,α-AgI晶体中能够迁移的全是Ag+,试分析Ag+能够发生迁移的可能原因。
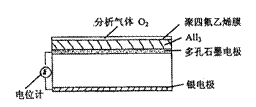
(5) 用一价正离子部分取代α-AgI晶体中的Ag+离子,得通式为MAgxI1+x的化合物。如RbAg4I5晶体,室温导电率达0.271Ω–1·cm–1。其中迁移的物种仍全是Ag+。利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以通过聚四氟乙烯薄膜,O2的含量可以由电池电动势变化得知。
① 写出传感器中发生的电极反应和化学反应方程式。
② 为什么由电池电动势的变化可以得知O2的含量?
18.锂离子电池的正极材料为层状结构的LiNiO2。已知LiNiO2中Li+和Ni3+均处于氧离子组成的正八面体体心位置,但处于不同层中。
(1) 将化学计量的NiO和LiOH在空气中加热到700℃可得LiNiO2,试写出反应方程式。
(2) 写出LiNiO2正极的充电反应方程式。
(3) 锂离子完全脱嵌时LiNiO2的层状结构变得不稳定,用铝离子取代部分镍离子形成LiNi1-yAlyO2,可防止锂离子完全脱嵌而起到稳定结构的作用,为什么?
17.石墨可用作锂离子电池的负极材料,充电时发生下述反应:
 Li1-xC6 + xLi+ + xe- LiC6
Li1-xC6 + xLi+ + xe- LiC6
其结果是,Li+嵌入石墨的A、B层间,导致石墨的层堆积方式发生改变,形成化学式为LiC6的嵌入化合物。
(1) 图二给出了一个Li+沿c轴投影在A层上的位置,试在图上标出与该离子临近的其它六个Li+的投影位置。
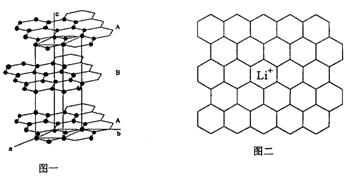
(2) 在LiC6中,Li+与相邻石墨六元环的作用力属何种键型?
(3) 假想石墨每个六元环下都对应一个Li+,写出其化学式,画出晶胞图(c轴向上)。
16.石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图一所示,图中用虚线标出了石墨的一个六方晶胞。
(1) 试确定该晶胞的碳原子个数。
(2) 写出晶胞内各碳的原子坐标。
(3) 已知石墨的层间距为334.8pm,C-C键长为142pm,计算石墨晶体的密度。
15.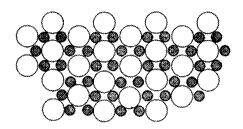 今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,右图是该晶体微观空间取出的部分原子沿c轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。(a = b≠c,c轴向上)
今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,右图是该晶体微观空间取出的部分原子沿c轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。(a = b≠c,c轴向上)
(1) 根据右图确定硼化镁的化学式。
(2) 画出硼化镁的一个晶胞的透视图,标出该晶胞内、面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com