
2.本章要求同学们:
①理解物体作曲线运动的条件,知道曲线运动中质点的速度沿轨道的切线方向,且必具有加速度;
②理解运动的合成与分解,知道合运动和分运动是同时发生的,并且互不影响,能在具体的问题中分析和判断运动的合成、运动的分解的具体意义,理解运动的合成和分解遵循平行四边形定则;
③知道什么是平抛运动,理解平抛运动是两个直线运动的合成:水平方向的匀速直线运动、竖直方向的自由落体运动,且这两个方向上的运动互不影响。掌握平抛运动的规律,会在实际问题中加以运用;
④理解匀速圆周运动,理解匀速圆周运动是变速运动,理解和掌握线速度、角速度、周期等概念,以及它们之间的关系;
⑤知道向心力、向心加速度及其方向,会根据向心力、向心加速度知识解释有关现象,计算有关问题,并且会在具体问题中分析向心力的来源,明确向心力是按效果命名的力。
⑥掌握应用牛顿运动定律解决匀速圆周运动问题的一般方法,会处理水平面、竖直面内的问题。
1.通过本节习题课的复习,进一步熟悉全章的基本内容,提高解决问题的能力。
6、胶体的提纯净化
利用渗析的方法,将胶体中的杂质离子或小分子除去。
① 实验步骤
(1)把10mL淀粉胶体和5mLNaCl溶液的混合液体,加入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图)(半透膜可用鸡蛋壳膜、牛皮纸、胶棉薄膜、玻璃纸等制成,它有非常细小的孔,只能允许较小的离子、分子透过)。
(2)2min后,用两支试管各取烧杯中的液体5mL,向其中一支试管里滴加少量AgNO3溶液,向另一支试管里滴加少量碘水,观察现象。
② 实验现象:可以看到在加入AgNO3溶液的试管里出现了白色沉淀;在加入碘水的试管里并没有发生变化。
③ 实验结论:Cl-能透过半透膜,从半透膜袋中扩散到了蒸馏水中,淀粉不能透过半透膜,没有扩散到蒸馏水中。胶体分散质的粒子比溶液分散质的粒子大。
④注意事项:半透膜袋要经检验未破损,否则,淀粉粒子也会进入蒸馏水。不能用自来水代替蒸馏水,否则,实验结论不可靠。一般要在2min以后再作Cl-的检验,否则,Cl-出来的太少,现象不明显。
说明:应用实验的原理和方法,可以除去胶体溶液中的离子或小分子杂质。为了提高除杂的速度和提高除杂的程度,要定期更换蒸馏水。应用渗析洁皿用流动水来精制胶体,若要检验半透膜袋有无损坏,则应取悬放过此袋样品的烧杯中少量溶液,向其中加入大量I2溶液,若变蓝,则可说明已损坏,淀粉胶体已透过半透膜进入水中。思考再进一步:能否用溴水代替碘水?何故?
5、胶体的应用
胶体的知识在生活、生产和科研等方面有着重要用途,如常见的有:
① 盐卤点豆腐:将盐卤(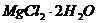 )或石膏(
)或石膏(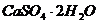 )溶液加入豆浆中,使豆腐中的蛋白质和水等物质一起凝聚形成凝胶。
)溶液加入豆浆中,使豆腐中的蛋白质和水等物质一起凝聚形成凝胶。
② 肥皂的制取分离 ③ 明矾、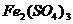 溶液净水④ FeCl3溶液用于伤口止血 ⑤ 江河入海口形成的沙洲⑥ 水泥硬化 ⑦冶金厂大量烟尘用高压电除去⑧ 土壤胶体中离子的吸附和交换过程,保肥作用
溶液净水④ FeCl3溶液用于伤口止血 ⑤ 江河入海口形成的沙洲⑥ 水泥硬化 ⑦冶金厂大量烟尘用高压电除去⑧ 土壤胶体中离子的吸附和交换过程,保肥作用
⑨ 硅胶的制备: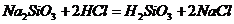
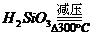
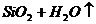
含水4%的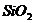 叫硅胶
叫硅胶
⑩ 用同一钢笔灌不同牌号墨水易发生堵塞
4、胶体的性质:
① 丁达尔效应--丁达尔效应是粒子对光散射作用的结果,是一种物理现象。丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。
② 布朗运动--在胶体中,由于胶粒在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动。是胶体稳定的原因之一。
③ 电泳--在外加电场的作用下,胶体的微粒在分散剂里向阴极(或阳极)作定向移动的现象。胶体具有稳定性的重要原因是同一种胶粒带有同种电荷,相互排斥,另外,胶粒在分散力作用下作不停的无规则运动,使其受重力的影响有较大减弱,两者都使其不易聚集,从而使胶体较稳定。
说明:A、电泳现象表明胶粒带电荷,但胶体都是电中性的。胶粒带电的原因:胶体中单个胶粒的体积小,因而胶体中胶粒的表面积大,因而具备吸附能力。有的胶体中的胶粒吸附溶液中的阳离子而带正电;有的则吸附阴离子而带负电胶体的提纯,可采用渗析法来提纯胶体。使分子或离子通过半透膜从胶体里分离出去的操作方法叫渗析法。其原理是胶体粒子不能透过半透膜,而分子和离子可以透过半透膜。但胶体粒子可以透过滤纸,故不能用滤纸提纯胶体。
B、在此要熟悉常见胶体的胶粒所带电性,便于判断和分析一些实际问题。
带正电的胶粒胶体:金属氢氧化物如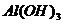 、
、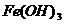 胶体、金属氧化物。
胶体、金属氧化物。
带负电的胶粒胶体:非金属氧化物、金属硫化物As2S3胶体、硅酸胶体、土壤胶体
特殊:AgI胶粒随着AgNO3和KI相对量不同,而可带正电或负电。若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电。当然,胶体中胶粒带电的电荷种类可能与其他因素有关。
C、同种胶体的胶粒带相同的电荷。
D、固溶胶不发生电泳现象。凡是胶粒带电荷的液溶胶,通常都可发生电泳现象。气溶胶在高压电的条件也能发生电泳现象。
胶体根据分散质微粒组成可分为粒子胶体(如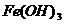 胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围),只有粒子胶体的胶粒带电荷,故可产生电泳现象。整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体。
胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围),只有粒子胶体的胶粒带电荷,故可产生电泳现象。整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体。
④聚沉--胶体分散系中,分散系微粒相互聚集而下沉的现象称为胶体的聚沉。能促使溶胶聚沉的外因有加电解质(酸、碱及盐)、加热、溶胶浓度增大、加胶粒带相反电荷的胶体等。有时胶体在凝聚时,会连同分散剂一道凝结成冻状物质,这种冻状物质叫凝胶。
胶体稳定存在的原因:(1)胶粒小,可被溶剂分子冲击不停地运动,不易下沉或上浮(2)胶粒带同性电荷,同性排斥,不易聚大,因而不下沉或上浮
胶体凝聚的方法:
(1)加入电解质:电解质电离出的阴、阳离子与胶粒所带的电荷发生电性中和,使胶粒间的排斥力下降,胶粒相互结合,导致颗粒直径>10-7m,从而沉降。
能力:离子电荷数,离子半径
阳离子使带负电荷胶粒的胶体凝聚的能力顺序为:Al3+>Fe3+>H+>Mg2+>Na+
阴离子使带正电荷胶粒的胶体凝聚的能力顺序为:SO42->NO3->Cl-
思考:① 淀粉胶体加入少量电解质能否使其凝聚?(否!)有无电泳现象?(无!)
思考:② 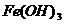 胶体中分别逐渐加入HCl溶液、MgCl2溶液,现象有何异同?为什么?(加入过量盐酸,使胶体凝聚成
胶体中分别逐渐加入HCl溶液、MgCl2溶液,现象有何异同?为什么?(加入过量盐酸,使胶体凝聚成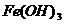 沉淀后又发生中和反应而溶解成FeCl3溶液,而MgCl2能使胶体凝聚而不能溶解)
沉淀后又发生中和反应而溶解成FeCl3溶液,而MgCl2能使胶体凝聚而不能溶解)
(2)加入带异性电荷胶粒的胶体:思考:将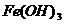 胶体和硅酸胶体混合有何现象?什么原因?
胶体和硅酸胶体混合有何现象?什么原因?
(3)加热、光照或射线等:加热可加快胶粒运动速率,增大胶粒之间的碰撞机会。如蛋白质溶液加热,较长时间光照都可使其凝聚甚至变性。
你知道豆腐的生产过程吗?为什么常常加入石膏?
注意:蛋白质变性凝聚(加热、加重金属盐等不属胶体意义上的凝聚,此变性过程为化学过程。)
3、胶体的制备
A. 物理方法
① 机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小
② 溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。
B. 化学方法
① 水解促进法:FeCl3+3H2O(沸)= 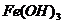 (胶体)+3HCl
(胶体)+3HCl
② 复分解反应法:KI+AgNO3=AgI(胶体)+KNO3 Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?
提示:KI+AgNO3=AgI↓+KNO3(黄色↓) Na2SiO3+2HCl=H2SiO3↓+2NaCl(白色↓)
2、胶体的分类:
①. 根据分散质微粒组成的状况分类:
如: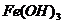 胶体胶粒是由许多
胶体胶粒是由许多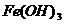 等小分子聚集一起形成的微粒,其直径在1nm-100nm之间,这样的胶体叫粒子胶体。 又如:淀粉属高分子化合物,其单个分子的直径在1nm-100nm范围之内,这样的胶体叫分子胶体。
等小分子聚集一起形成的微粒,其直径在1nm-100nm之间,这样的胶体叫粒子胶体。 又如:淀粉属高分子化合物,其单个分子的直径在1nm-100nm范围之内,这样的胶体叫分子胶体。
②. 根据分散剂的状态划分:
如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、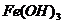 溶胶、
溶胶、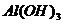 溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。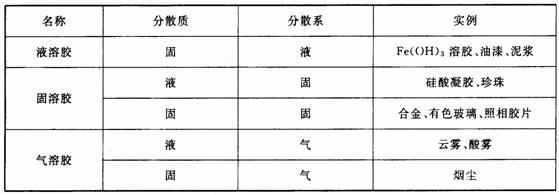
1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。

下面比较几种分散系的不同:
|
分散系 |
溶 液 |
胶 体 |
浊 液 |
|
|
分散质的直径 |
<1nm(粒子直径小于10-9m) |
1nm-100nm(粒子直径在10-9 ~ 10-7m) |
>100nm(粒子直径大于10-7m) |
|
|
分散质粒子 |
单个小分子或离子 |
许多小分子集合体或高分子 |
巨大数目的分子集合体 |
|
|
实例 |
溶液酒精、氯化钠等 |
淀粉胶体、氢氧化铁胶体等 |
石灰乳、油水等 |
|
|
性 质 |
外观 |
均一、透明 |
均一、透明 |
不均一、不透明 |
|
稳定性 |
稳定 |
较稳定 |
不稳定 |
|
|
能否透过滤纸 |
能 |
能 |
不能 |
|
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
|
鉴别 |
无丁达尔效应 |
有丁达尔效应 |
静置分层 |
注意:三种分散系的本质区别:分散质粒子的大小不同。
3. 分散剂:分散质分散在其中的物质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com