
27、(16分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O
NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
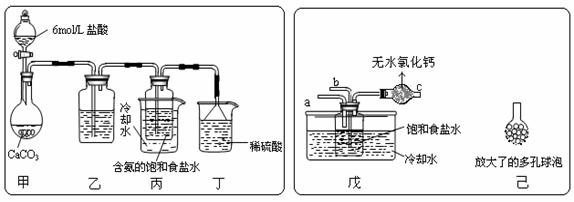
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
26、(6分)在含有Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。(1)在原溶液中滴加足量的饱和氯水后,有气泡产生,溶液呈橙黄色;(2)向橙黄色溶液中加入BaCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,该溶液中肯定不存在的离子是 ,还有一种离子无法确定,请你补充实验确定该离子是否存在,实验方法是: 。
25、(18分)某些化学反应可用下式表示
A + B ─→ C + D + H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,则A与B的组合是:
或 。
(3)若A为黑色固体,C是黄绿色的单质气体,写出该反应的离子方程式: 。
(4)若A为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
(5)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
24、(9分)汽车行驶会产生污染大气的尾气CO、NO、NO2等。现在已发明一种装有特殊催化剂的装置,使氮的氧化物与一氧化碳相互反应,生成氮气和二氧化碳。
(1)试写出NO、NO2分别与CO反应的化学方程式:
① 。
② 。
(2)若用NOx表示氮氧化物的化学式,试写出它与CO反应的化学方程式:
。
23、(8分)利用下列反应原理可以用于检查司机是否酒后开车。
2K2Cr2O7 + 3C2H5OH + 8H2SO4 = 2Cr2(SO4)3 + 3CH3COOH + 2K2SO4 + 11
橙色 绿色
(1)化学方程式中空格内的物质是(填化学式) 。
(2)若司机酒后开车,检测仪器内物质显示出 色。
(3)在反应中,铬元素的化合价从 价变为 价。
(4)如果在反应中生成1molCr3+,转移的电子总数为 个。
22、某无色气体可能含HCl、HBr、SO2、CO2中的一种或几种。将该气体通入到适量氯水中,恰好完全反应,不再剩余气体。将所得到的无色溶液分别装在两支试管中,分别加入酸化的AgNO3溶液、酸化的BaCl2溶液,均产生白色沉淀。则下列判断正确的是 ( )
A.原气体中一定有SO2,一定没有HBr B.原气体中可能有SO2
C.不能确定有无HCl和HBr,但一定没有CO2 D.原气体中一定有HCl
第Ⅱ卷(共84分)
21、将足量的氯气通入下列溶液中,溶液中溶质产生阴阳离子的结构都改变的是( )
A.AgNO3 B.Na2CO3 C.NaOH D.FeBr2
20、将NaCl和NaBr的混合物mg,溶于足量的水配成500mL溶液A,再向其中通入足量的Cl2,充分反应后蒸发至干,得固体(m-2)g,则A溶液中Na+、Br-、Cl-的物质的量浓度之比不可能是 ( )
A.3 :2 :1 B.3 :1 :2 C.4 :3 :2 D.5 :1 :4
19、下列除去杂质的方法正确的是 ( )
|
|
物 质 (杂 质) |
除 杂
方 法 |
|
A |
Cl2(HCl) |
将气体通过盛有氢氧化钠溶液的洗气瓶 |
|
B |
C2H4(SO2) |
将气体通过盛有高锰酸钾溶液的洗气瓶 |
|
C |
氢氧化铁胶体(FeCl3) |
将混合物直接过滤 |
|
D |
SiO2 (CaCO3) |
加入盐酸后过滤 |
18、某无色溶液中可能含有①Na+ 、②Ba2 +、 ③Cl一、 ④Br一、⑤SO32一、⑥SO42一 离 子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是 ( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是①③⑤ D.不能确定的离子是③⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com