
27.(12 分)A 、B 、C 、D 四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
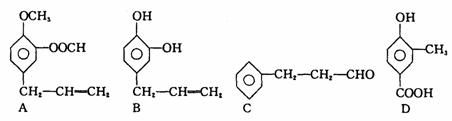
请回答下列问题:
(1)写出D 中含氧官能团的名称:__________________; l mol B 能与________molBr2反应;
(2)用A 、B 、C 、D 填空:
① 能发生银镜反应的有__________________
② 既能使FeCl3溶液显紫色,又能和NaHCO3 反应放出气体的有______________
(3)如图:
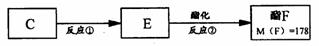
C 经一步反应可生成E , E 是B 的同分异构体,则反应① 属于_______________反应(填反应类型名称);反应② 的化学方程式为____________________________;
(4)同时符合① 化合物是1 , 2 一二取代苯,② 苯环上的两个取代基分别为羟基和
含有一COO一结构基团要求的D的同分异构体有4 种。
其中两种是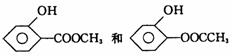 ,则另外两种的结构简式为
,则另外两种的结构简式为
________________________________________________________________
写出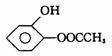 与足量NaOH溶液反应的化学方程式:
与足量NaOH溶液反应的化学方程式:
__________________________________________________________________。
26.( 8 分)已知A 是一种常见的盐,B 、C 、K 为常见金属,K 的氧化物是耐火材料,且能溶于碱溶液。G 为淡黄色固体,H 、F 为无色气体,F 在空气中会变成红棕色。它们的转化关系如下图所示(个别产物略去)。
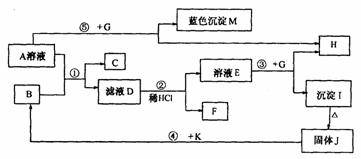
请回答下列问题:
(1)A 的化学式为______________________
(2)在反应① ② ③ ④ 中属于置换反应的是___________________________
(3)反应② 的离子方程式为__________________________________________
(4)反应⑤ 的总反应化学方程式为__________________________________(填序号)。
25. ( 8 分)现有A 、B 、C 、D 、E 、F 六种短周期元素,原子序数依次增大。已知A 与D 、C 与E 分别同主族,D 、E 、F 同周期.A、B 的最外层电子数之和与C 的最外层电子数相等,A 分别与B 、C 形成电子总数相等的分子,且A 与C 形成的化合物常温下均为液态,A 分别与E 、F 形成电子总数相等的气体分子。
请回答下列问题:
(1)元素F 在周期表中的位置________________________________________;
(2) A 、C 、D 三种元索可组成一种常见化合物,该化合物的化学式________________;生产该化合物和单质F 的工业称为____________工业;
(3)B 与F 形成的化合物分子中,各原子均达8 电子结构,则该分子的电子式为
_________________________________________;
(4)已知0 . 5 mol EC2 被C2 氧化成气态EC3,放出49.15kJ热量,其热化学方程
式为_______________________________________________________________;
(5) A 、B 、C 以原子个数比4 : 2 : 3 所形成的化合物,晶体类型为________。
24.(10分)(1)在氯化铁溶液中,加入难溶的碳酸钙粉末,发现碳酸钙粉末逐渐溶解,同时产生的现象有:
①____________________________________________________________________
②____________________________________________________________________。
(2)向含有氯化钡的氯化铁溶液中通入二氧化硫,有白色沉淀,此外还可产生的现象是___________________________________________________________,其离子反应方程式为__________________________________________________________。
(3)欲从酸化的氯化铁溶液中制得氯化铁晶体(FeCl3· 6H2O) 实验基本操作是:将溶液蒸发、浓缩、______________________、_________________、过滤、干操。蒸发浓缩中使用的陶瓷仪器名称是________________________。玻璃棒在过滤中的作用:__________
22.将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用
1mol·L-1的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL ,原合金中钠的质量为( )
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
第II 卷(非选择题,共56 分)
|
已知某温度下,Kw=l×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(l)若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=
_________________;若此时溶液中阳离子浓度大于阴离子浓度,其原因可能是(用文字表述)___________________________________________________________
(2)若A的化学式为HR, B的化学式为MOH,且a+b ==3。若两者等体积混合后溶液显碱性,则其原因可能是_________________________________________,
此混合后的溶液中,微粒浓度大小关系一定正确的是_______________填序号)。
① c(MOH ) > c ( M + ) > c ( R一)> c ( H + ) > c ( OH一)
② c( HR ) > c ( M + ) > c ( R一)> c ( OH一)> c ( H + )
③ c( M + )> c ( R一)> c ( H + ) > c ( OH一)
④ c( M + ) > c ( R一)> c ( OH一)>c(H + )
⑤ c( M + ) + c ( H + ) == c ( R 一)+ c ( OH一)
⑥ c( MOH) == c (H +)一c(OH一)
21.电瓶车所用电池一般为铅蓄电池,是一种典型的可充电电池,如下图所示。电池总反应式为:
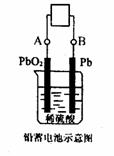
Pb+PbO2+4H+ + SO42-=2PbSO4+2H2O。则下列说法正确的是 ( )
A.放电时:电流方向由B 到A
B.放电时:正极反应是Pb一2e-+SO42-
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4一2e一+2H2O=PbO2+SO42-+4H+
20.下列实验结果符合下边图像所示关系的是 ( )
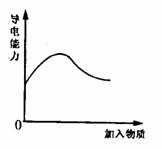
A.将CO2通入KA1O2 溶液
B.H2O2溶液中加入少量MnO2
C.向浓的CH3COOH 溶液中不断加水
D.将氨气通入醋酸溶液中。
19.根据相关化学原理,下列推断正确的是 ( )
A.若弱酸HA 的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
B.若X原子的质子数为a,中子数为b,则X 的质量数为:a一b
C.若R2-离子和M+离子的电子层结构相同,则R2-和M+的化学性质相同
D.若有反应A2+2D-=2A-十D2,则氧化性:D2>A2
18.下图是红磷P(s)和Cl2(g)发生反应生成PC13(g)和PC15(g)的反应过程和能量关系图。
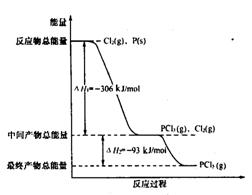
其中PCl5(g)分解成PC13 (g)和Cl2的反应是一个可逆反应。温度t℃时,在密闭器中加入0.6molPCl5,达平衡时PCl5还剩0.45mol,其分解率为α。则下列推断正确的是( )
A.α等于25%
B.若升高温度,平衡时PCl5的分解率小于a
C.若起始时加人0.6 molPC13和0.6 molCl2,以相同的条件进行反应,则平衡时PC13转化率为3α
D.其他条件不变,增大压强,PCl5的转化率小于α
17.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和碳酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀硫酸③ 向AgNO3溶液中逐滴加入过量氨水④ 向硅酸钠溶液中逐滴加入过量的盐酸 ( )
A.① ② B.① ③ C.① ④ D.② ③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com