
22.(8分)烯烃通过臭氧化并经锌和水处理得到醛或酮,例如:
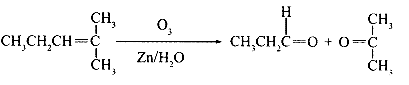
一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢ll.6%,B无银镜反应。D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。其转化关系如图所示。
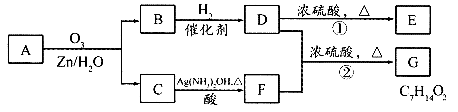
请回答下列问题:
(1)B的相对分子质量是
(2)写出结构简式:A 、E
(3)指出反应类型:① ,② 。
(4)写出反应②的化学方程式: 。
21.(共10分)下面是关于硫化氢的部分文献资料。
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
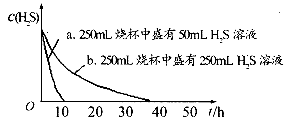
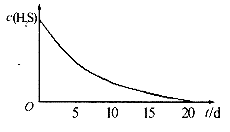
实验一:将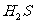 气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。如图所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。如图所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
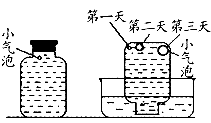
实验二:密闭存放的氢硫酸,每天定时取lml。氢硫酸,用相同浓度的碘水滴定,图所示为氢硫酸浓度随放置天数变化的情况。
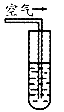
实验三:在饱和氢硫酸溶液中以极慢的速度通人空气(1-2个气泡/min),数小时未见变浑浊的现象(如图)。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加.这种气泡也略有增多(大),浑浊现象更明显些(如图)。
请回答下列问题:
(1)实验一(图)中,氢硫酸的浓度随时问变化而减小的主要因素是
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了 的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明) 。此实验中通人空气的速度很慢的主要原因是什么?
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是 。为进一步证实上述原因的准确性,还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?
20.(10分)A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,它们之间存在如图所示的转化关系。由此推断:
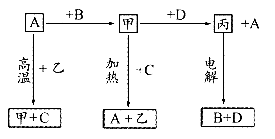
(1)元素A有可变化合价,则A单质的名称 ,甲的化学式为 ,乙的电子式为 。
(2)试判断A和C的还原性强弱(在通常条件下).A C(填“大于”或“小于”)。
(3)写出甲和D反应的化学方程式: 。
(4)已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式:
19.(8分)
(1)双氧水(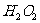 )和水都是极弱电解质,但
)和水都是极弱电解质,但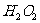 比
比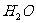 更显酸性。
更显酸性。
若把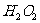 看成是二元弱酸,请写出它在水中的电离方程式: 。
看成是二元弱酸,请写出它在水中的电离方程式: 。
鉴于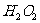 显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出
显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出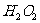 与
与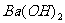 作用形成正盐的化学方程式: ;
作用形成正盐的化学方程式: ;
水电离生成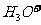 和
和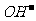 叫做水的自偶电离。同水一样,
叫做水的自偶电离。同水一样,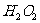 也有极微弱的自偶电离,其自偶电离的方程式为: 。
也有极微弱的自偶电离,其自偶电离的方程式为: 。
(2)常温下某无色透明溶液中所含的离子仅有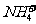 和
和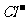 等四种离子,请回答下列问题:
等四种离子,请回答下列问题:
①该溶液所含的离子中除上述两种外还应有 (填离子符号)两种离子。
②该溶液所含的上述四种离子的物质的量浓度大小有多种可能,填写下面的两种可能:
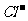 >
> >
>
> > 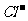 >
> >
>
> >
③如溶液中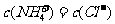 ,则溶液中的溶质为 (填化学式)。该溶液的pH 7(填“<”、“>”或“=”)
,则溶液中的溶质为 (填化学式)。该溶液的pH 7(填“<”、“>”或“=”)
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 ml。饱和氯水,按图所示装置进行实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。请回答:
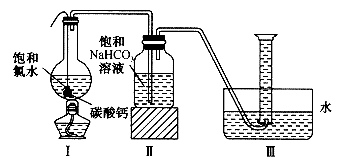
(3)为减少用装置Ⅲ收集气体过程中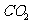 因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的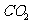 气体BL,发现
气体BL,发现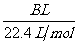 明显小于
明显小于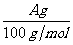 。若不考虑实验操作和
。若不考虑实验操作和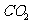 的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是 。
的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是 。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是
①如图所示,在试管中加入过量的块状碳酸钙,再加入约20 ml,饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为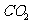 。请问答:
。请问答:

(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知,②的滤液中的溶质除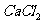 、HClO外,还含有
、HClO外,还含有
18.(12分)饱和氯水与石灰石的反应是制取较浓HCl0溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
17.(10分)(1)图所示装置为化学实验中常见的仪器,它除了用于洗气外,还有其他用途。
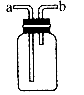
①医院给病人输氧时往往在氧气罐与病人呼吸器之间安装盛水的该装置,通过观察气泡产生情况以便调节供氧速率,此时氧气从 口导入。
②实验室用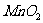 和浓HCl制
和浓HCl制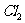 实验中,将生成的
实验中,将生成的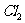 通入NaOH溶液之前,先将
通入NaOH溶液之前,先将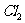 从该装置 管进,从 管导出,此时该装置起的作用是防止NaOH倒流。
从该装置 管进,从 管导出,此时该装置起的作用是防止NaOH倒流。
③当用此装置收集NO时,需采取什么措施?
(2)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光。回答下列问题:
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。
②通过挤压,使过氧化氢与革酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高黏度的有机化合物)
③在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放人冰箱的冷冻室中,发光便会停止或基本停止。把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么?
16.一定温度下,有可逆反应:2A(g)+2B(g)  C(g)3D(g);
C(g)3D(g);
现将2mol A和2 mol B充人体积为V的甲容器,将2mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积为2V(如图所示),保持反应过程中两容器的温度与起始时相同。下列说法正确的是
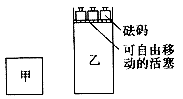
A.甲、乙两容器中的反应达到化学平衡时,两容器内压强相等
B.甲、乙两容器中的反应达到化学平衡时,C的体积分数相等
C.向甲容器中再充人2 molA和2 molB,平衡后甲中物质C的浓度不变
D.向乙容器中再充入2 molC和6 molD,平衡后乙中物质C的浓度为原来的2倍
15.下列变化能够实现的是:①弱酸与盐溶液反应生成强酸;②两种氧化物发生反应有气体生成;③两种酸的溶液充分反应后溶液呈中性;④复分解反应中既没有生成水,也没有生成沉淀和气体
A.只有①③ B.只有②④
C.只有①②④ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com