
3.下列关于电解槽的叙述中不正确的是 ( )
A.电子从源的负极沿导线流入电解槽的阴极
B.与电源负极相连的是电解槽的阴极
C.与电源正极相连的是电解槽的阴极
D.在电解槽的阳极发生氧化反应
2. 下列物质都能和水反应,在反应中水既不被氧化又不被还原,而该反应属于氧化还原反应的是 ( )
A.三氧化硫 B.二氧化氮 C.氟气 D.氧化钠
1.有关氧化还原反应实质的说法中正确的是 ( )
A.是否有电子转移 B.是否有元素的化合价的变化
C.是否有氧元素参加 D.是否有原子的重新组合
7.5×10-3mol·L-1。
(1)计算800℃,1.0×105Pa条件下,上述反应的平衡常数K= 。
(2)800℃,1.0×105Pa条件下,起始时在上述容器中加入1molCO、1molH2O、2molH2、2molCO2,则此反应的初始状态 (填“是”、“否”)为平衡状态;若是平衡状态不必做答,若不是平衡状态,反应将向 (填“正”、“逆”)反应方向进行以达到化学平衡状态。
(3)在800℃,1.0×105Pa条件下,将4molCO和4molH2O投入密闭容器中进行上述反应,达到平衡后,H2的物质的量为a mol,CO的转化率为α,则a= ,α= 。
23.(10分)在800℃密闭容器中进行反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为
22.(14分)二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g)
 2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
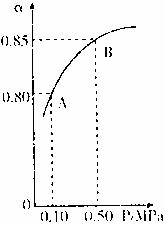
①平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列选项中有利于提高SO2平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出氧气
③SO2尾气用Na2SO3溶液吸收可得到重要化工原料,反应的化学方程式为
;上述反应产物的水溶液呈酸性,请解释原因 。
④工业制硫酸中SO2的一种制法是煅烧FeS2制取,煅烧FeS2的产物之一Fe3O4溶于H2SO4后,加入Fe粉可制取FeSO4,酸溶过程需保持溶液足够酸性,其原因是
。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2的整个过程中转移的电子总数为
(阿伏加德罗常的值用NA表示),写出上述反应的热化学方程式:
。
21.(12分)
已知反应:3I-(aq)+S2O82-(aq)
 I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式K= 。
(2)下图表示反应过程中有关物质的能量,则反应的△H 0(填>、<、=)。
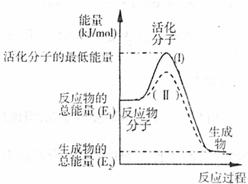
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
|
c(S2O82-/mol·L-1) |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
|
t/s |
88 |
44 |
22 |
11 |
t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
1.0×10-26mol2·L-2,则溶液的pH= 。
(II)Fe(OH)2固体容易被氧化而不易制取且难以长期保存,为此某同学设计了如图所示装置制取Fe(OH)2。
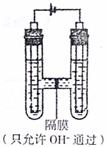
(1)装置中阳极材料应为 。
(2)装置中的电解质溶液可以选用 。
A.NaCl溶液 B.Na2SO4溶液
C.FeCl2溶液 D.稀硫酸
(3)根据(2)的选择,写出装置中反应的总化学反应方程式
20.(12分)
(I)如图装置中,试管A、B的电极为多孔的惰性电极。通直流电,实验现象如图所示。
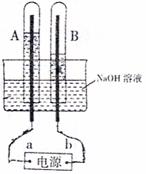
(1)a是电源的 极。A管中电极反应式 。
(2)撤掉电源,将A、B试管中的电极用导线相连即可组成氢氧燃料电池,则B试管中的电极反应式: 。
(3)电解后的溶液恢复到室温,若溶液中水电离产生的H+和OH-浓度乘积为
19.(8分)回答下列有关问题
(1)醋酸铵水解的离子方程式为:
CH3COO-+NH4++H2O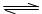 CH3COOH+NH3·H2O
CH3COOH+NH3·H2O
如何判断溶液的酸碱性
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: ;有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请您运用所学知识解释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com