
4.2004年4月16日重庆天原化工总厂的氯气贮罐发生泄漏,严重影响了附近群众的生命安全。下列有关安全措施中不正确的是
A.可用毛巾蘸取石灰水捂嘴
B.在氯气泄漏的地区人应站在高处
C.向氯气中喷洒水
D.将泄漏的氯气在空气中点燃除去
3.对盐类物质可有下列分类:如氯化硝酸钙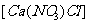 是一种混盐,硫酸铝钾
是一种混盐,硫酸铝钾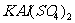 是一种复盐,冰晶石(六氟合铝酸钠)
是一种复盐,冰晶石(六氟合铝酸钠)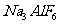 是一种络盐。对于组成为
是一种络盐。对于组成为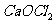 的盐可归类于
的盐可归类于
A.混盐 B.复盐
C.络盐 D.无法归属于上述类别
2.可在有机物中引入羟基的反应类型有
①取代、②加成、③消去、④酯化、⑤氧化、⑥还原
A.①②③ B.①②⑤⑥
C.①④⑤⑥ D.①②③⑥
1.自英国科学家狄拉克提出反粒子存在的预言,人类开始在茫茫宇宙中寻找反物质的例证。后又聚焦于反物质的合成研究。1997年人类首次合成了9个反氢原子。2002年是人类合成反物质的丰收年,合成了5万个反氢原子.也是对狄拉克诞辰100周年祭典的一份厚礼。反氢原子的组成为
A.由l个带负电荷的质子与一个带正电荷的电子构成
B.由l个带正电荷的质子与一个带负电荷的电子构成
C.由1个不带电荷的中子与一个带负电荷的电子构成
D.由l个带负电荷的质子与一个带负电荷的电子构成
20.(10分)往200mL NaOH溶液中通入CO2,充分反应后,在减压和低温下,小心将溶液蒸干,得白色固体M。通入CO2的体积V(CO2)(mL)(标准状况下)与M的质量(g)的关系如下图。试通过分析和计算回答下列问题(要求写出简要计算过程):
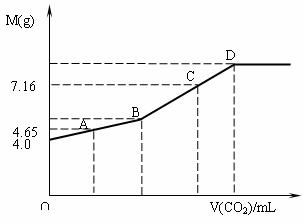
(1)B点时,白色固体M的化学式_________,通入CO2的体积为______________mL。
(2)D点时,通入CO2的体积为__________mL。
(3)C点时,通入CO2的体积为__________mL。
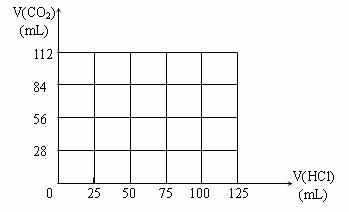
(4)取组成为A点的白色固体1/10,向其中逐滴加入0.1mol/LHCl溶液,请在下图中画出产生CO2气体体积(标准状况下)与所加入的盐酸的体积关系:
19.(10分)将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量是多少?(写出计算过程)
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3)若在另外一个2 L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A.c(NO)=0.35 mol·L-1或c(NO)=0.09 mol·L-1
B.c(NO2)=0.4 mol·L-1
C.c(NO2)=0.35 mol·L-1
D.c(O2)=0.2 mol·L-1或c(NO)=0.4 mol·L-1
附加题
18.(12分)实验是化学的最高法庭。以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极。某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
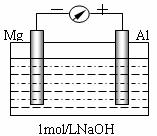
如图,剪取约8cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500μA的教学演示电表的“-”、“+”端相连接,迅速将两电极插入盛有1mol/LNaOH溶液的烧杯中。开始,电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是____(填“Mg”或“Al”)片;铝片表面产生的气泡是____;负极发生的反应是 。
(2)随后阶段,铝片发生的电极反应式是______________________________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-=H2↑+2OH-(极少),试判断此电极发生的主要反应是_________________________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是 。
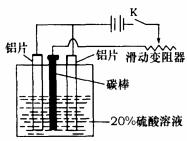
17.(15分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 g NaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如上图,组装好仪器,接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
阳极: ;
阴极:
(4)断开电路,取出铝片,用1%稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式 。
16.(16分)某校化学研究性学习小组要利用已经学过的化学知识制取少量漂白粉,并进一步探究漂白粉的化学性质。他们查阅资料得知:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O是放热反应,温度稍高时便发生副反应:6Cl2+6Ca(OH)2→Ca(ClO3)2+5CaCl2+6H2O。学生设计出了甲、乙、丙三套装置:
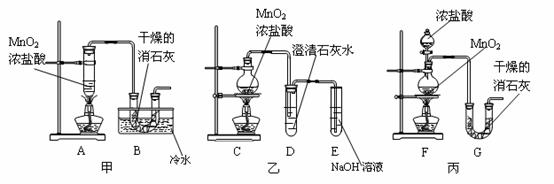
(1)请从甲、乙、丙各套装置中选取合理的部分,按气体从左至右的流向组装成一套较合理的装置,(填各部分仪器的编号)
(2)部分学生认为上述组装仍存在缺点,他们指出在前两个仪器之间应增加如下装置:
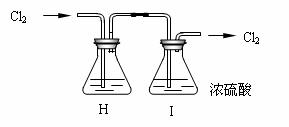
你认为H洗气瓶中所盛液体是 ,其作用是 。
若无此装置,对制漂白粉有什么不利影响 ;
洗气瓶I有无必要 理由是 。
(3)为了研究所制得的漂白粉的化学性质,同学们把少量漂白粉投入到淡绿色的FeCl2溶液,所产生的现象是 。由此可知漂白粉溶液所具有化学性质是 。四、(本题包括2小题,共27分)
15.(12分)实验室用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
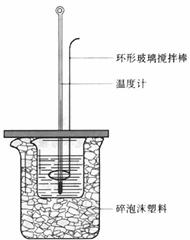
(1)大小烧杯间填满碎泡沫塑料的作用是 。
(2) (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是 。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是 (填“偏高”或“偏低”或“无影响”)。
(4)如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量 (“增加”、 “减少”或“不变”),理由是 ;所求中和热数值 (“增加”、 “减少”或“不变”),理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com