
24.(14分)某学生课外小组利用电解原理做如下实验,实验装置如图所示,若电解5min时铜电极质量增加2.16g,试回答:
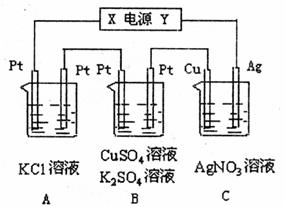
(1)电源电极X名称为 。
(2)写出C中的电极反应式 。
(3)B中pH变化情况 (填“大”“小”“无变化”)
并描述B中能观察到的现象 。
(4)通过5min时,B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为 。
(5)若A中KC1溶液的体积也是200mL,电解后溶液的pH= 。
23.(10分)已知1molCO气体完全燃烧生成CO2气体放出的283kJ热量;1mol氢气完全燃烧生成液态水放出286kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出氢气燃烧的热化学方程式 。氢气的燃烧热是 。
(2)若1mol液态水汽化时需要吸收44kJ的热量,请写出CH4燃烧生成气态水的热化学方程式 。
(3)若将amol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水时,则放出热量(Q)的取值范围是 。
(4)若将a molCH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是 。
22.(6分)
1)某反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:

配平上面化学方程式,将系数填入方框中。
(2)3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,反应如下所示:
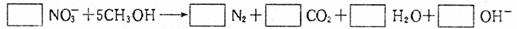
配平上面化学方程式,将系数填入方框中。
21.(7分)对于反应14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,
(1)请用双线桥标出电子转移的方向和数目: 。
(2)氧化剂 还原剂 氧化产物 还原产物 。
20.按甲图所示装置进行实验,乙图表示实验中y的量与通电时间(t)的关系,则乙图中y可表示的量是 ( )
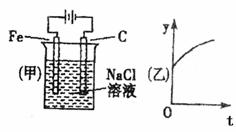
①Fe的质量②H2的物质的量③C1-的浓度④Na+的浓度⑤pH
A.①② B.②③ C.③④ D.①⑤
19.在25℃时,用铂电极电解一定量的Na2CO3饱和溶液。一段时间后,阳极析出a/2mol气体,同时溶液中析出bgNa2CO3·10H2O,如果在这一过程中温度不变,则此时Na2CO3溶液中溶质的质量分数为 ( )
A.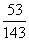 ×100% B.
×100% B.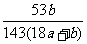 ×100%
×100%
C.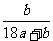 ×100% D.
×100% D.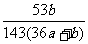 ×100%
×100%
18.在水中加入等物质的量的Ag+、Ba2+、Na+、SO42-、NO3-、C1-,该溶液放在用惰性材料做电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为 ( )
A.35.5:108 B.16:37 C.8:1 D.108:35.5
17.火法炼铜得到的粗铜中含有多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用的电解精炼法将粗铜提纯。在电解精练时 ( )
A.精炼时粗铜做阳极
B.精炼时粗铜接电源负极
C.杂质都将以单质形式沉积到池底
D.若纯铜片增重2.56g,电路中通过电子的物质的量为0.32mol
16.Cu2S可与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO和NO2的物质的量比为1:1时,实际参加反应的Cu2S与实际被还原的HNO3的物质的量之比为 ( )
A.1:7 B.1:9 C.1:5 D.2:9
15.在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01molC12,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于 ( )
A.0.0075mol·L-1 B.0.008mol·L-1
C.0.075mol·L-1 D.0.080mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com