
3.下列离子方程式正确的是 ( )
A.在明矾溶液中加入过量的氨水 Al3++4OH-=== AlO2-+2H2O
B.漂白粉溶液中通入过量的二氧化碳 Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
C.FeBr2溶液中加入过量的氯水 2Br-+Cl2===Br2+2Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液:
Ca2++2OH-+2HCO3-====CaCO3↓+2H2O+CO32-
2.为提纯下列物质(括号内的是杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
1.2008年北京奥运会“祥云”火炬用的环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ·mol-1,下列有关说法正确的是 ( )
A.丙烷燃烧的热化学方程式C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ·mol-1
B.奥运火炬燃烧主要是将化学能转变为热能和光能
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷的沸点比丁烷高
26.(1)现用氯化氢气体溶于水制取盐酸,要配制6.00mol/L的盐酸250mL,需要标准状况下的氯化氢气体多少升?
(2)取上述所配制的6.00mol/L盐酸100 mL与足量石灰石完全反应后,可生成标准状况下多少升二氧化碳?
25.(9分)现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4 、NaCl、CuSO4.进行如下实验:
①溶于水得无色溶液
②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失。
根据上述实验现象推断:
(1)一定不存在的物质是 (填化学式,下同)
(2)一定存在的物质是
(3)可能存在的物质
(4)对可能存在的物质应如何进一步检验,写出有关化学方程式:
24.(8分)实验室用下列仪器和药品制取并收集干燥纯净的氯气。
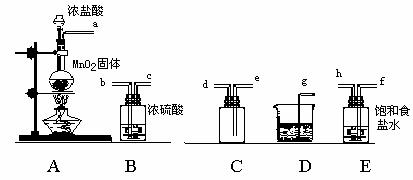
(1)按气流从左到右,装置正确的连接是:A接( )、( )接( )、( )(填装置下的大写字母)
(2)装置D的作用是 ,装置E的作用是 。
(3)装置A中的反应化学方程式 。
23.(6分)实验室配制500mL 0.100mol/L Na2CO3溶液,请回答下列问题:
(1)需称量 g的Na2CO3固体。
(2)配制上述溶液除需要玻璃棒、药匙外,还需要的仪器有 。
(3)人们常将配制过程简述如下:其正确的操作顺序是 (填各步骤序号)。
A.冷却;B.洗涤;C.称量;D.溶解;E.定容;F.摇匀;G.移液
22.(21分)
①某粒子结构示意图为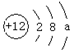 ,该粒子的核电荷数为_______;共有
个电子层,第二层上有
个电子。当a= 时,表示原子结构示意图;当a= 时,表示的是阳离子结构示意图。
,该粒子的核电荷数为_______;共有
个电子层,第二层上有
个电子。当a= 时,表示原子结构示意图;当a= 时,表示的是阳离子结构示意图。
②同温同压下,同体积的CH4和NH3分子个数比为 质量之比为 氢原子个数比为 密度之比为 。
③10g 2H216O中含电子 mol,中子数为 个。
④常温下,将100 mL 10.00 mol/L的H2SO4,加水稀释到500 mL,所得H2SO4的浓度为 ,若用2.00 mol/L的NaOH中和此溶液,需NaOH的体积是 。
21.(10分)按下列要求填写化学用语:
① Ba(OH)2溶于水时的电离方程式:
②Al2(SO4)3溶于水时的电离方程式:
③工业生产氯气的化学方程式:
④CO2与足量KOH反应的化学方程式:_
⑤氯化铵与浓的氢氧化钠溶液混合加热时有氨气放出的化学方程式:
。
20.配制一定体积一定物质的量浓度溶液时,下列情况对实验结果产生偏高影响的是( )
A.定容时仰视刻度线
B.定容时俯视刻度线
C.摇匀后发现液面低于标线,再继续滴加蒸馏水至标线
D.容量瓶中还有蒸馏水时即配制溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com