
19.现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
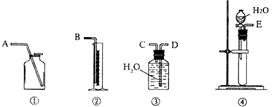
所选用装置的连接顺序应是(填各接口的字母): 。
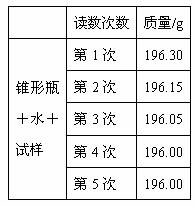
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g、锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表:计算CaC2的质量分数时,必需用到的表中数据是 。不必作第6次读数的原因是 。此试样中CaC2的质量分数为 。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下:
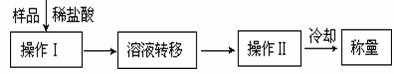
①操作Ⅱ的名称是 。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果 (填“偏大”、“偏小”或“不变”)。
③请指出该实验方案的至少1个不足之处 。
④请你改进找到的方案中的不足之处 。
18.相对分子质量为M的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为ω%,物质的量浓度为c mol/L,密度为ρ g·cm-3,则下列说法正确的是 ( )
A.溶液密度ρ可表示为: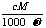 B.物质的量浓度C可表示为:
B.物质的量浓度C可表示为: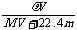
C.溶液的质量分数ω%可表示为: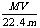 D.相对分子质量M可表示为:
D.相对分子质量M可表示为: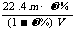
第Ⅱ卷(非选择题,共56分)
17.把一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6L(在标准状况下.)。将反应后的溶液稀释到1 L,测得溶液的pH=1,则下列叙述正确的 ( )
A.气体Y是SO2 B.气体Y中SO2和H2的体积比为4:1
C.反应中共消耗锌87.5g D.反应中共转移电子3 mol
16.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)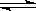 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
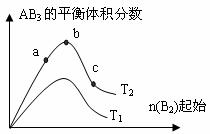
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1∶3
15.某二元酸(化学式H2A)在水中的电离方程式是:H2A
= H+ + HA-,HA- H++A2-又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是 ( )
H++A2-又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是 ( )
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验: ( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.100mL溶液中含0.01mol CO32- B.Cl-一定存在
C.K+一定存在 D.Ba2+一定不存在,Mg2+可能存在
13.甲、乙两杯醋酸稀溶液甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲由水电离出来的H+的物质的量浓度是乙的1/10倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍
A.①②④正确 B.①③正确 C.②④正确 D.只有①正确
12.珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是 ( )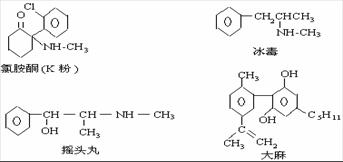
A.这四种毒品都属于芳香烃
B.摇头丸不可能发生加成反应
C.1mol大麻最多可与含4mol Br2 的浓溴水发生反应
D.K粉的分子式为C13H16ClNO
|
11.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法一定正确的是 ( )

A.60g SiO2晶体中,含有2×6.02×1023个Si-O键
B.标准状况下,2.24LCHCl3含有的分子数为0.1×6.02×1023
C.720g C60晶体含有6.02×1023个如图中晶胞单元
D.7.8g Na2O2中含有的离子总数为0.3×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com