
20、(共8分)钠和铝是两种重要的金属。请回答:
(1)钠元素的金属性比铝的_________(填“强”或“弱”);常温下,可用_________(填“钠”或“铝”)制成的容器盛装浓硫酸或浓硝酸。
(2)将一小块金属钠投入水中,发生反应的化学方程式为_____________;可观察到的实验现象是_________(填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)铝与氢氧化钠溶液反应的离子方程式为______________ 。
19、(12分)海水中有非常丰富的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。
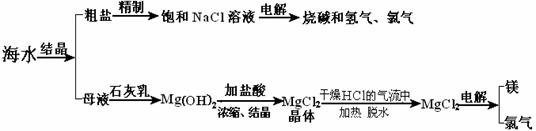
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式____________________________________ 。
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液中加入石灰乳起什么作用? ;
Mg(OH)2 沉淀中混有Ca(OH)2应该怎样除去?写出实验步骤: 。
(3)海水中的镁元素处于游离态还是化合态? ;从海水中提取MgCl2的反应是不是氧化还原反应? ;用电解法冶炼金属镁的反应是不是氧化还原反应? 。
(4)用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热
MgCl2•6H2O时,能得到无水MgCl2,其原因是 。
(5)电解无水氯化镁所得的镁蒸汽冷却后即为固体镁。请思考镁蒸汽可以在下列哪种气体氛围中冷却? _______________________________
A、H2 B、CO2 C、空气 D、O2 E、Ar
(6)实验室里将粗盐精制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
过滤时:
蒸发时:
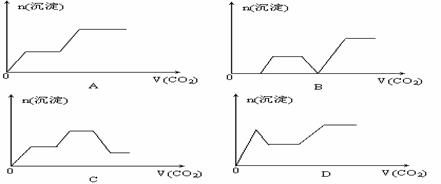
18、将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合液中,生成沉淀与通入CO2的量的关系可表示为 ( )
第II卷(非选择题,共46分)
17、有镁铝混合粉末10.2g,将它溶于500mL 4mol/L的盐酸里,若要使沉淀质量达到最大值,则需加入2mol/L的氢氧化钠溶液的体积为( )
A、100mL B、500mL C、1000mL D、1500mL
16、某种混合气体,可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积变小;最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是( )
A.一定没有N2,HCl和CO至少有一种 B.一定有N2、HCl、CO
C.一定有N2,HCl和CO中至少有一种 D.一定有N2与HCl,一定没有CO
15、还原2.4×10-3mol XO(OH)3+到X元素的低价态时,消耗0.2mol/L的Na2SO3 溶液30mL,则X元素的低价态是( )
A.+1 B.-1 C.0 D.-2
14、下列反应属于非氧化还原反应的是 ( )
A.2Na2O2 + 2H2O == 4NaOH + O2↑
B.3H2O2 + 2KCrO2 + 2KOH == 2K2CrO4 + 4H2O
C.2KI + O3 + H2O == 2KOH + I2 + O2
D.ICl + H2O == HCl + HIO
13、200℃时,11.6gCO2和H2O的混合气体与足量过氧化钠充分反应后固体质量增加了3.6g,则混合气体的平均相对分子质量为( )
A.5.8 B.21.6 C.23.2 D.46.4
12、在下列反应过程中,有3mol电子转移的是( )
A.lmol钠与水反应 B.27g铝与足量盐酸反应
C.22.4L氧气(标准状况)与足量镁反应 D.1.5mol Na2O2与足量水反应
11、①氧化钠 ②氢氧化钠 ③过氧化钠 ④亚硫酸钠。1mol上述固体物质长期放置于空气中,最后质量增加的大小关系(不考虑潮解因素)正确的是( )
A.①=②>③>④ B.①>③>④>② C.②>①>③>④ D.④>②>③>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com