
1、在强碱性无色透明溶液中,能够大量共存的离子组是( )
A.K+ NH4+ Cl- NO3- B.MnO4- K+ NO3- Cl-
C. K+ Na+ CO32- Cl- D.Mg2+ HCO3- SO42- K+
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。请回答:
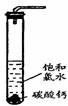
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现B/22.4 moL明显小于A/100 moL。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是 。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是 。
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。 经检测,上述实验中产生的无色气体均为CO2。请回答:
(1)反应后所得的溶液漂白性增强的原因是 。
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有 。
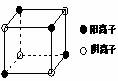
21A.(物质结构与性质)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的 (填序号):
①A单质>B单质>R; ②R>A单质>B单质;
③B单质>R >A单质; ④A单质>R>B单质。
(2)在CB3分子中C元素原子的原子轨道发生的是____杂化,其固体时的晶体类型为 。
(3)写出D原子的核外电子排布式 ,C的氢化物比D的氢化物在水中溶解度大得多的可能原因 。
(4)下图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为 ,FeD2物质中具有的化学键类型为 。
21B.(化学实验)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
20.将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
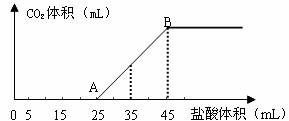
(1)写出OA段所发生反应的离子方程式______________________________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
19.已知水解聚马来酸酐得到的有机物HPMA被普遍用在锅炉中作阻垢剂。按下图步骤可以用不饱和烃A合成HPMA
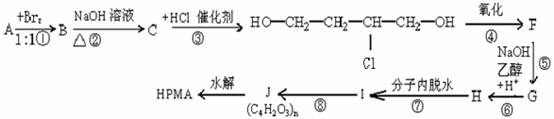
(1)写出结构简式:A ,C 。
(2)反应①属于 反应,反应②属于 反应。(填反应类型)
(3)写出②、⑧反应的化学方程式
②
⑧
(4)在上述合成路线中,有人提议略去③④⑤⑥反应,由C直接制得H而使实验简化,请你评价该建议是否合理?理由是什么?
理由是: 。
18.下图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为有颜色的固体。
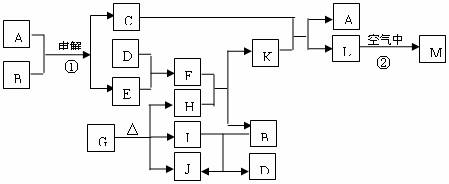
(1)写出:A的电子式 ,J的结构式 ,M的化学式 。
(2)基于反应①原理的化学工业称为 ,写出该反应的化学方程式 。
(3)写出K和E反应的离子方程式 。
写出F溶液和H反应的离子方程式 。
(4)已知由G分解得到的H、I、J三者的物质的量相等,则G的化学式为 。
17.(1)已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a= mol·L-1。
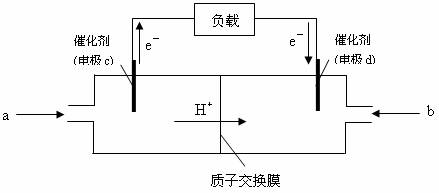
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为
。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
16.科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如下。

水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是 分子。请你展开想象,给“热冰”设计一个应用实例 。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是 。
②由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式 。
15.化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能。
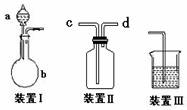
(1)甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入 或 ,b仪器中加入 或 (与a中分别对应)。装置Ⅱ从 管口进气即可作为O2的收集装置。
(2)丙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
(3)戊同学认为利用装置Ⅰ和装置Ⅲ可进行验证Cl2的氧化性比Br2强的实验,进行此项实验时在装置Ⅰ中的a仪器中加入___________试剂,b仪器中加入________ 试剂,装置Ⅲ中应加入适量的 试剂,根据装置Ⅲ中观察到的 实验现象即可得出Cl2的氧化性比Br2强的结论。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com