
7.下列实验操作完全正确的是
|
编号 |
实 验 |
操 作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1000 mL |
准确称取氯化钾固体,放入到1000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
6.下列关系正确的是
A.离子半径: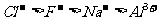
B.熔点:石英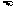 食盐
食盐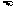 干冰
干冰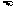 冰
冰
C.结合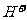 能力:
能力: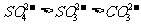
D.热稳定性:
5.向50mLl8mo1.L-1H2SO4溶液中加入足量的Cu片并加热。充分反应后,被还原的H2SO4的物质的量为
A.小于0.45mol B.等于0.45mol
C.在0.45mol和0.90mol之间 D.大于0.90mol
4.下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
3.下列叙述正确的是
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
2.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
1.判断下列有关化学基本概念的依据正确的是
A.金属晶体:晶体是否能够导电
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.氧化还原反应:元素化合价是否变化
21.有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量 242g/mol。取1.21g此晶体溶于水,配制成100mL溶液。将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32g。
(1)x值是多少?
(2)求M的相对原子质量和n值。
(3)如电解过程中溶液体积不变,计算电解结束后溶液的PH。
20.(12分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸氨,再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
。(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A、凯氏烧瓶中溶液转移到容量瓶中时,未洗涤凯氏烧瓶
B、定容时,俯视刻度线
C、定容时,仰视刻度线
D、移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为 。
已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7 + 2HCl + 5H2O =2NH4Cl + 4H3BO3
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为 。
19.(14分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回答下列问题:
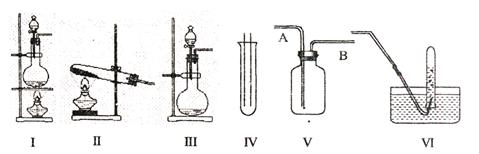
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)
用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com