
31.(10分)有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
(1)加入AgNO3,溶液有黄色沉淀生成;
(2)加入淀粉,未见蓝色;
(3)在逐滴加入1mol·L-1NaOH溶液的过程中,未闻到刺激性气体,随NaOH溶液的滴入,产生沉淀的量如图所示,试确定:
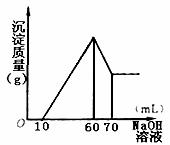
(1)溶液中一定存在的离子有 ;
(2)其中阳离子物质的量分别为 。
30.(9分)现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约6mL和检验氯气的氧化性(不应将多余的氯气排入空气中)。
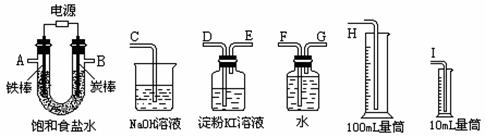
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填号)是:A接__________________________,B接__________________________;
(2)铁棒接直流电源的________极;炭棒上发生的电极反应为 。
(3)能说明氯气具有氧化性的实验现象是_________________________________ _;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__________。
29.(9分)化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3,和Na2CO3,与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
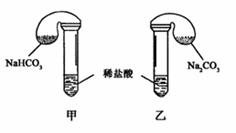
请回答:
(1)各组反应开始时_____________,装置中的气球体积先变大,该装置中反应的离子方程式是________________________________________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
|
|
试剂用量 |
实验现象 (气球体积变化) |
分析原因 |
|
第 ① 组 |
0.42 g NaHCO3 0.53 g Na2CO3 3mL4 mol/L盐酸 |
甲中气球与乙中 气球的体积相等 |
甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) ν甲(CO2)=ν乙(CO2) |
|
第 ② 组 |
0.3
g NaHCO3 0.3 g Na2CO3 3mL4 mol/L盐酸 |
甲中气球比乙中 气球的体积大 |
|
|
第 ③ 组 |
0.6
g NaHCO3 0.6 g Na2CO3 3mL2 mol/L盐酸 |
甲中气球比乙中 气球的体积大 |
|
|
片刻后,乙中气球 又缩小,甲中气球 的体积基本不变 |
(用离子方程式表示) |
28.(10分)某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种硅酸盐仪器是 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
选用试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(变灰色部分不必填写):
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
Fe2+具有 还原性 |
|
② |
在FeCl2溶液中加入锌片 |
|
Zn+Fe2+=Zn2++Fe |
|
|
③ |
在FeCl3溶液中加入足量铁粉 |
|
Fe+2Fe3+=3 Fe2+ |
Fe3+具有 氧化性 |
|
④ |
|
|
|
Fe3+具有 氧化性 |
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该 防止亚铁盐被氧化。
27.(9分)某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是 反应物之一。根据你学过的有关化学定律和知识,回答下列问题:
(1)铅(Pb)的常见化合价是 ,将Pb3O4写成常见化合价的氧化物的形式为 __ (已知Fe3O4可写成FeO·Fe2O3)。
(2)已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
(3)Pb(N3)2在该反应中是 剂,它对应的产物是 ,1mol
Pb(N3)2参加反应,转移电子数是 mol。
26.(8分)氰(CN)2的结构简式为N≡C-C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)写出下列反应的化学方程式:
①(CN)2和NaOH溶液反应 ,
②MnO2和HCN反应 ,
③向KCN和KI混合溶液中加入少量溴水 ,
④在NaBr和KCN混合溶液中通入少量Cl2 。
(2)HCN的电子式为 。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价),反应的离子方程式如下:aCN-+bClO-+2cOH- =dCNO-+eN2↑+fCO32-+bCl-+cH2O上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1∶2 B.1∶1 C.2∶1 D.不能确定
②若d=e=1,则b= 。
25.(12分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。

请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是 。
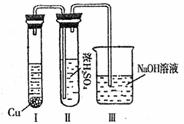
③已知常温下物质A与物质B生成1mol气体C的△H为-57.07kJ·mol-1,1 mol气体C与H2O反应生成D溶液和E气体的△H为-46kJ ·mol-1,写出物质A与物质B及水生成D溶液的热化学方程式 。
24.(12分)铝是地壳中含量最多的金属元素,1854年法国化学家德维尔用金属钠还原氯化钠和氯化铝的复盐,获得了金属铝单质。1886年,美国人豪尔和法国人海郎特,分别独立地电解熔融的氧化铝和冰晶石的混合物,制得了金属铝,奠定了今天大规模生产铝的基础。
工业生产金属铝的原料是铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2),工业中得到较纯氧化铝的过程如下图所示:
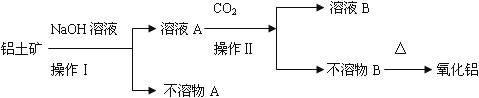
试回答下列问题:
(1)操作Ⅰ是一种重要的混合物分离方法,实验室进行该项操作用到的玻璃仪器有烧杯、
、 。
(2)经分析不溶物A的主要成分为 。
(3)工业上电解炼铝的化学方程式为: ,若电路中通过1mol电子,可以得到铝 g
(4)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
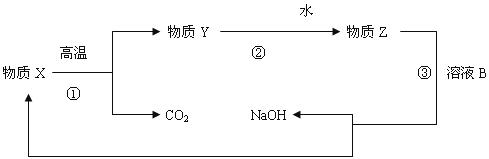
①上述转化中未涉及到四种基本反应类型中的 反应;
②写出转化③的化学方程式(该反应在工业生产中称为苛化法) 。
(5)科学研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出二条杜绝铝元素过量吸入的措施: 。
23.(5分)请按要求填空:
(1)某种液化后常作为致冷剂的气态氢化物的空间结构为 形;
(2)最高正化合价和最低负化合价的绝对值之差为6的短周期元素的原子结构示意图 ;
(3)医疗上常用作消毒剂的某过氧化物(可看作二元弱酸)的电离方程式 ;
(4)钢铁发生吸氧腐蚀时的正极反应式 ;
(5)某钠盐能使紫色石蕊试液先变蓝后褪色。用离子方程式表明原因 。
22.将AlCl3溶液和NaOH溶液等体积混合,所得沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则原AlCl3溶液和NaOH溶液物质的量浓度之比可能是:①2∶3 ②1∶2 ③3∶10 ④2∶7 中的 ( )
A.①② B.②③ C.①④ D.③④
第Ⅱ卷(非选择题 共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com