
5.已知31g白磷变成红磷放出18.39kJ热量,下列两反应中:
4P(白、S)+5O2(g)=2P2O5(s),△H=Q1kJ/mol
4P(红、S)+5O2(g)=2P2O5(s),△H=Q2kJ/mol
则Q1和Q2的关系是:( )
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
4.一定条件下硝酸铵受热分解的反应式为:NH4NO3→HNO3+N2+H2O 在反应中,被氧化与被还原的氮原子个数之比为 ( )
A.5:3 B.5:4 C.1:1 D.3:5
3.下列叙述中正确的是 ( )
A.CO2分子内含有极性键,所以CO2分子是极性分子
B.分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C.气态氢化物的稳定性:NH3>PH3>AsH3
D.某非金属元素从游离态变成化合态时,该元素一定被还原
2.据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1H原子核和2个电子构成。下列关于这种粒子的说法中,正确的是( )
A.它是氢的一种新同位素 B.这种新元素的核电荷数是3
C.它是H2的一种新同素异形体 D.它比一个普通氢分子多-个氢核
1.下列各对物质间的反应既属于氧化还原反应,又属于离子反应的是 ( )
A.Zn+H2SO4(稀) B.NaCl+AgNO3(溶液)
C.H2+O2 D.Na2O+H2O
32.(8分)现有一种铜粉与氧化铜粉末的混合物:
(1)经测定该混合物中铜元素与氧元素的质量之比为6:1,则混合物中铜粉与氧化铜的物质的量之比为 ;112g上述混合物在加热条件下与足量的浓硫酸充分反应后,产生SO2的物质的量为 mol;
(2)若铜粉与氧化铜粉末的混合物中氧元素的质量分数为0.1,则160g该混合物在加热条件下与足量的浓硫酸反应,消耗硫酸的物质的量为 mol;
(3)设混合粉末中氧元素的质量分数为x,160g该混合物与足量的浓硫酸反应,消耗硫酸的物质的量为y mol,写出x的取值范围 ,及y与x之间的关系式 。
31.(2分)将10g CO2和CO的混合气体,通过装有足量Na2O2的干燥管,反应后干燥管的总质量增加了5.6g,则原混合气体中CO2的质量分数为
30.(14分)W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是________;Z元素是_________。
(2)化合物WY和WX2的化学式分别是__________和___________。
(3)Y和Z形成的两种常见化合物的分子式是_________和_________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式___________。
29.(12分) 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL回答下列问题:
(1)步骤①中A仪器最好用 _____________(填仪器名称)
(2)能否用胶头滴管代替步骤②中的滴定管?其原因是______ _____
(3)能否用水代替苯_____________理由是__________________
(4)已知NaCl晶胞的结构如下图所示,经X射线衍射测得晶胞中最邻近的Na+和C1-平均距离为acm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=_____________。
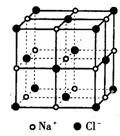
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为_____________。
28.(6分)(1)SiO2晶体中,1个Si原子可与______ 个O原子形成共价键。
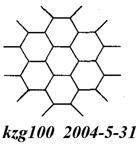
(2)下图为石墨的晶体结构俯视图。在石墨晶体中C原子数与C-C键数之比为___。
(3)C100H120为含多个C≡C的链状化合物的分子式,该分子中含C≡C最多有______个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com