
1.设NA为阿伏伽德罗常数的值,下列叙述中正确的是 ( )
A.含NA个氧分子的氧气的质量为32g
B.lmolCH3Cl与lmolSiO2中所含的共价键数目均为4NA
C.标准状况下,22.4LCl2参加反应时所转移的电子数目一定是2NA
D.lmol·L-1盐酸和loml·L-1CH3COOH溶液中的H+数目,前者有NA个,后者少于NA个
34.(7分)如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
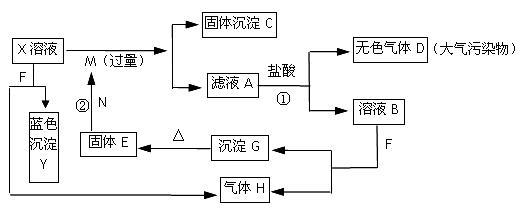
⑴X的化学式为 ;F的电子式为 。
⑵反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
⑶若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设溶液体积不变)
33.(6分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。
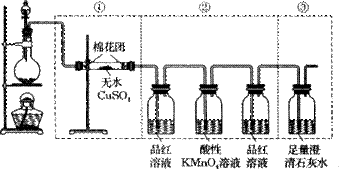
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_______,不能检出的物质是________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____,不能检出的物质是_________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是______,不能检出的物质是_________。
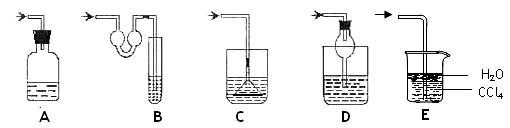
32.(12分)(1)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有__________
(2)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(3)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②下图是酸式滴定管中液面在滴定前后的读数:

c(NaOH)=
③若在滴定前酸式滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
31.(8分)配平下面化学方程式(将系数填写在括号内)
(1)( ) FeO + ( )HNO3= ( ) Fe(NO3)3+ ( )NO↑+
(2)( )Cu2S+ ( )HNO3= ( )Cu(NO3) 2+ ( )NO↑+ ( )H2SO4+ ( )H2O
其中(2)中还原剂是_______, 氧化产物为________________.
30.(14分)
(1)在1~18号元素中,除稀有气体元素外:
原子半径最大的元素是 ,原子半径最小的元素是 。
单质的还原性最强的元素是 ,单质的氧化性最强的元素是 。
(2)用电子式表示:
NaBr形成的过程: ,
N2形成的过程:___________________________________,
H2O形成的过程:_________________________________
29.(2分)将一无色固体与Cu片和浓H2SO4混合共热,产生红棕色气体,由此可得出关于此无色固体是 。
28.下列说法中正确的是:
A.NO2、BF3、NCl3分子中没有一个分子中所有原子的最外层电子都满足了8e- 稳定结构;
B.P4和CH4都是正四面体分子且键角都为109o28ˊ;
C.NaCl晶体中与Na+相距最近的Na+共有12个;
D.由原子间通过共价键而形成的晶体一定具有较高的熔、沸点及硬度。
27.从下列事实所得出的相应结论正确的是
|
|
实验事实 |
结论 |
|
A |
常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 |
非金属性:P>N |
|
B |
CO2的水溶液可导电 |
CO2是电解质 |
|
C |
SO2通入硝酸钡溶液出现白色沉淀 |
沉淀为硫酸钡 |
|
D |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
同浓度的pH:NaAlO2>
NaHCO3 |
26.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
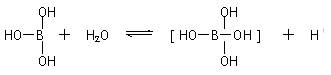
下列判断正确的是
A.凡是酸或碱对水的电离都是抑制的
B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-=[B(OH)4]-
D.硼酸是两性氢氧化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com