
1. 随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是 ( )
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60是原子晶体 D.H2与H3属于同素异形体
24.(11分)下图所示物质转化中,常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
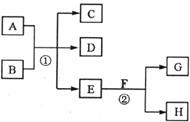
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是__________;
(2)若反应①在加热条件下进行,且C、D是两种均能使澄清石灰水变浑浊的无色气体,则反应①的化学方程式是______________________________;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时反应①的离子方程式是__________ ______________________________;
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素构成。则A过量时反应①的化学方程式是________________________________________。
23.(8分)如下图所示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
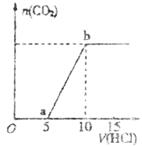
(1)写出a点以前发生反应的离子方程式:______________________________。
(2)写出a点到b点发生反应的离子方程式:______________________________。
(3)若某Na2CO3溶液中含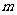 mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中
mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中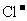 和
和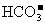 的物质的量之比为2︰1,则滴入稀盐酸的物质的量等于__________mol(用
的物质的量之比为2︰1,则滴入稀盐酸的物质的量等于__________mol(用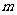 表示)。
表示)。
22.(10分)A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种,已知:①A与B反应有气体生成;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥在②和③的反应中生成的沉淀是同一种物质。请填空:
(1)②和③的反应中,生成的沉淀物质的化学式(分子式)是__________。
(2)A是_________,B是_________,C是_________,D是_________,E是_________。
(3)A与E反应的离子方程式是______________________________。
21.(8分)汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。请回答下列相关问题:
(1)次氯酸盐是一些漂白剂和消毒剂的有效成分。84消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为________________________________________;
(2)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为____________________;
(3)过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是__________(填序号);
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(4)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为: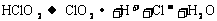 (未配平)。当1 mol HClO2发生分解反应时,转移的电子数是__________。
(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是__________。
20.(10分)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如下图1所示)。
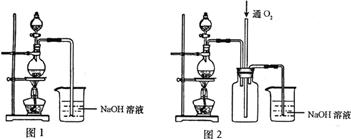
请回答相关问题:
(1)图1分液漏斗中装的液体是__________;
(2)本实验中若硝酸过量,造成的结果是______________________________;
(3)图2是图1的改进装置,其优点是①__________________,②__________________;
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向混合物中加入Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
①方案1中用于灼烧铜粉的仪器名称是__________;
②方案2中甲物质可以是__________(填字母序号);
a.CuO b.CuCO3 c.CaCO3 d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)____________________。
19.(7分)实验室常用的几种气体发生装置如下图A、B、C所示:
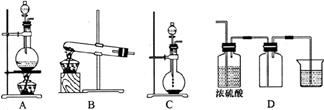
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是__________。检查C装置气密性是否良好的操作方法是______________________________。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是__________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
18.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得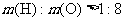 。下列对导致这一结果的原因的分析中,一定错误的是
。下列对导致这一结果的原因的分析中,一定错误的是
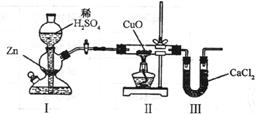
A.I、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
第Ⅱ卷(非选择题 共54分)
第Ⅱ卷共6个小题。
17.现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现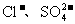 和
和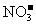 的相互分离:
的相互分离:
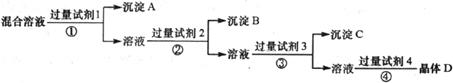
其中试剂1、2、4分别为
A.氯化钡溶液 硝酸银溶液 稀硝酸
B.氯化钡溶液 稀硝酸 硝酸银溶液
C.氢氧化钠溶液 硝酸银溶液 稀硝酸
D.硝酸银溶液 硝酸钡溶液 稀硝酸
16.将1.12g铁粉加入25 mL 2 mol/L FeCl3溶液中,充分反应后,其结果是
A.铁有剩余,溶液呈浅绿色,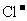 浓度基本不变
浓度基本不变
B.向溶液中滴入无色的KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5:1
D.氧化产物与还原产物的物质的量之比为2︰5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com