
1.高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述不正确的是( )
A.臭氧和氧气是氧的同素异形体 B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害 D.臭氧是很好的消毒剂和脱色剂
30.(6分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)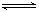 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,n1(N2)=13 mol,n1(NH3)=6 mol,计算a的值。
(2) 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)。
n1(始)∶n1(平)= 。
(4) 原始混合气体中,a∶b= 。
29.(12分)短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
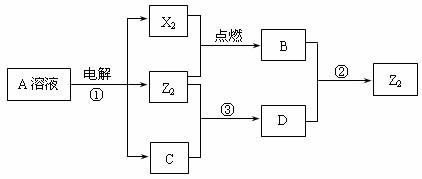
(1)Y在周期表的位置是______________;Z2的电子式是____________________。
(2)反应①的化学方程式是________________________________________________。
(3)D溶液呈碱性的原因是(用离子方程式表示)_________________________________;
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)
一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室
利用反应②的原理来制备纯净.干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。
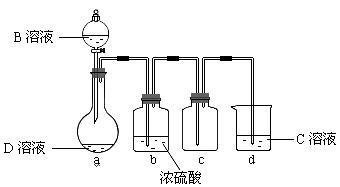
I.写出反应②的离子方程式_____________________ _____。
II.上述实验装置不够完善,改进方法是 。
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
3Z2+6C  5A+YZO3+3H2O ,
5A+YZO3+3H2O ,
3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是________________。
28.(14分)钢铁工业是国家工业的基础。请回答钢铁冶炼.腐蚀.防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_____________________________ 。
(2)铁是一种重要的催化剂,请写出铁在有机反应中做催化剂的化学方程式:
____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的化学方程式______________________________ 。
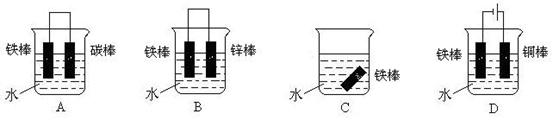
(4)下列哪个装置可防止铁棒被腐蚀_____________ 。
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
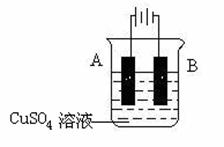
请回答:
① A电极对应的金属是______(写元素名称),B电极的电极反应式是 。
② 若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,
二者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③ 镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
27.(10分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图。加热聚丙烯废塑料得到的产物如下表:
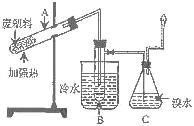
|
产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可以制取高聚物聚乙炔。
A中残留物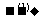 电石
电石 乙炔
乙炔 聚乙炔
聚乙炔
写出反应②-③的化学方程式
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 . 。
26.(8分)原子序数从小到大排列的四种短周期元素W、X、Y、Z,四种元素的原子最外层电子数之和等于12;W是原子半径最小的元素;由X、Y元素可组成非极性分子A,A在常温下为气体; 由Y、Z元素按原子个数比1:1可组成离子化合物B;A与B反应可生成Y2气体。
(1)元素W是: ;写出B的电子式
(2)写出金属镁在A中燃烧的化学方程式:
该反应属于 (填写序号)
a 置换反应 b 化合反应 c 分解反应 d 复分解反应 e 氧化还原反应
(3)C是由X、Y 、Z三种元素组成的盐,C能与盐酸反应生成A,则C的化学式是
(4)D是由W、X 、Y 三种元素按原子个数比为1 :1 :2组成的一种酸,D在常温下为固体。已知在含1molD的水溶液中加入1molC恰好反应生成1molA。则D的化学式是 ;D能使高锰酸钾酸性溶液褪色,说明D具有 性。
25.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
( )
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)
24.“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图
下列关于“诺龙”的说法中不正确的是 ( )
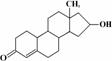
A.分子式是C18H26O2
B.能在NaOH醇溶液中发生消去反应
C.既能发生加成反应,也能发生酯化反应
D.既能发生氧化反应,也能发生还原反应
23.恒温条件下,把NO2装入带活塞的密闭容器中,当反应2NO2 N2O4达到平衡后,慢慢压缩,下列叙述正确的是 ( )
N2O4达到平衡后,慢慢压缩,下列叙述正确的是 ( )
A.体积减半,则压强为原来的两倍
B.平衡向右移动,混合气体的颜色一定会变浅
C.体积减半,压强增大,但小于原来的2倍
D.平衡向右移动,混合气体密度增大
22.在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是( )
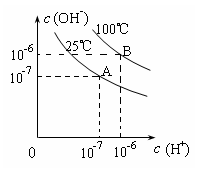
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7
C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com