
5.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中含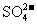
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
4.下列表述正确的是
①普通玻璃与钢化玻璃成分不同,所以性能不同,用途不同
②光导纤维导电能力很强,是非常好的通讯材料
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④氧化钴加入到普通玻璃中可制成红色玻璃
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
3.用下图表示的一些物质或概念间的从属关系中不正确的是
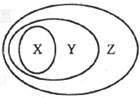
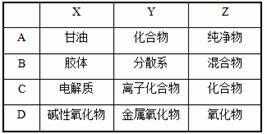
2.镁粉有重要的用途。工业上制造镁粉是将镁蒸气在某气体中冷却,下列可作为镁蒸气的冷却气的是
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①和② B.②和⑤ C.③和④ D.④和⑤
1.用经Cl2消毒的自来水配制下列溶液:①Na2SO3、②KI、③AlCl3、④FeCl2、⑤AgNO3、⑥稀盐酸,发现部分药品变质,它们是
A.①②④⑤ B.①③④⑤ C.①②④ D.③⑥
24.(11分)下图所示物质转化中,常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
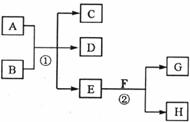
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是__________;
(2)若反应①在加热条件下进行,且C、D是两种均能使澄清石灰水变浑浊的无色气体,则反应①的化学方程式是______________________________;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时反应①的离子方程式是__________ ______________________________;
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素构成。则A过量时反应①的化学方程式是________________________________________。
23.(8分)根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1:上述四种元素均为短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息1,X一定不是__________(填序号);
A.氢 B.碳 C.氧 D.硫
信息2:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素__________(填“是”或“否”);
信息3:向上述四种元素的单质组成的混合物中加入足量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成白色沉淀物的化学式为__________;
信息4:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的化学式为__________。
22.(10分)A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
(1)A在元素周期表中的位置是____________________;
(2)C的元素名称是__________;
(3)D元素离子的结构示意图为____________________;
(4)B和E可形成BE3、B2E4等化合物,BE3的电子式为__________________,B2E4的结构式为__________________。
21.(8分)汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。请回答下列相关问题:
(1)次氯酸盐是一些漂白剂和消毒剂的有效成分。84消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为________________________________________;
(2)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为____________________;
(3)过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是__________(填序号);
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(4)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为: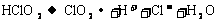 (未配平)。当1 mol HClO2发生分解反应时,转移的电子数是__________。
(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是__________。
20.(10分)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如下图1所示)。
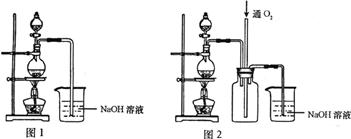
请回答相关问题:
(1)图1分液漏斗中装的液体是__________;
(2)本实验中若硝酸过量,造成的结果是______________________________;
(3)图2是图1的改进装置,其优点是①__________________,②__________________;
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向混合物中加入Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
①方案1中用于灼烧铜粉的仪器名称是__________;
②方案2中甲物质可以是__________(填字母序号);
a.CuO b.CuCO3 c.CaCO3 d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com