
27.(16分)a、b、d、e是短周期元素,周期表中a与b、b与c相邻;a与c的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是 。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示) ;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为 ,Z的晶体类型为 。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示) 。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8mol稀盐酸溶液完全反应,并收集到0.25mol气体,则用物质的量表示该固体物质组成为 、 。
26.(13分)如下图所示,常温下电解5 min后,铜电极质量增加2.16g。试回答:
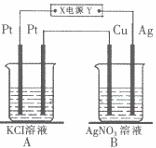
(1)电源电极X名称为 (填“正极”或“负极”)。
(2)电解池B中阳极的电极反应式是 。
(3)若A中KCl溶液的体积是200mL,电解后溶液的PH= (忽略电解前后溶液体积的变化)。若要使电解后的溶液恢复到与电解前完全相同,应加入 。
(4)已知在101kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是: 。
13.已知氧化还原反应:
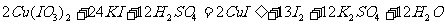 其中1mol氧化剂在反应中得到的电子为( )
其中1mol氧化剂在反应中得到的电子为( )
A.10mol B.11mol C.12mol D.13mol
第Ⅱ卷(共10小题,共174分)
12.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:
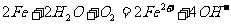 以下说法正确的是( )
以下说法正确的是( )
A.负极发生的反应为: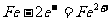
B.正极发生的反应为:
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
11.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是( )
pC(g)+qD(g);△H<0。下列结论中正确的是( )
A.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若温度、体积不变,当m+n<p+q时,则往平衡体系中再加入少量气体E(E与所有组分均不反应),A的转化率减小
D.若升高温度,则反应中逆反应速率减小,正反应速率增大
10.下列4组溶液,不用其他试剂也能鉴别开来的是( )
①AgNO3溶液、稀氨水 ②NaAlO2溶液和盐酸
③NaHCO3、NaHSO4、Ba(NO3)2、CuCl2 ④NaNO3、FeCl3、NaCl、AgNO3
A只有① B.只有①② C.只有①②③ D.全部
9.X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述错误的是( )
A.原子序数X>Y B.Y元素的阴离子半径大于其原子半径
C.离子半径X>Y D.原子的电子层数X>Y
8.下列方程式书写正确的是( )
A.浓硫酸跟铜反应: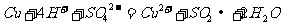
B.在氯化铝溶液中加入过量氨水: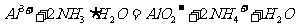
C.澄清石灰水中加入盐酸: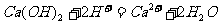
D.溴化亚铁溶液中通入过量氯气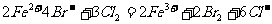
7.以NA表示阿伏加德罗常数,下列说法正确的是( )
A.如果5.6L N2含有n个氮分子,则阿伏加德罗常数一定约为4n
B.1mol 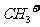 (碳正离子)中含有电子数为10NA
(碳正离子)中含有电子数为10NA
C.标准状况下,22.4LCCl4所含的原子数为5NA
D.60gSiO2中含Si-O键的个数为4 NA
6.下列叙述正确的是( )
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3,是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com