
6.水热法制备Fe3O4纳米颗粒的总反应为:3Fe2+ + 2S2O32- + O2 + xOH-=Fe3O4 + S4O62- + 2H2O。下列说法正确的是
A.硫元素被氧化,铁元素被还原 B.Fe2+、S2O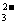 都是还原剂
都是还原剂
C.每生成1mol Fe3O4,转移电子数为3mol D.x=2
5.下列化学药品的贮存方法正确的是
A.新制氯水存放在带玻璃塞的无色细口瓶中
B.少量白磷存放在CS2中
C.碳酸钠固体保存在带橡胶塞的广口瓶中
D.NaF溶液保存在带橡胶塞的细口瓶中
4.分析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;
③冰和干冰都既是纯净物又是化合物; ④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋都既是化合物又是酸; ⑥纯碱和熟石灰都是碱;
⑦有色玻璃和雾都是胶体; ⑧酸酐都是非金属氧化物。其中正确的是
A.①②③④⑧ B.①②⑤⑥⑧
C.③⑤⑥⑦⑧ D.①③④⑦
3.设NA为阿伏加德罗常数的值,下列说法正确的是
①常温常压下,32g 16O2和32g 16O3所含有的中子数都为16 NA;
②在标准状况下,2.24 L的CCl4中含有C-Cl键的数目为0.4NA;
③7.8g Na2O2中所含有的阴离子数目为0.1NA;
④1L 0.1 mol·L-1的FeCl3溶液中,Fe3+的数目为0.1NA
A.①②③④ B.①②③ C.①③ D.①
2.下列各选项所述的两个量,前者一定大于后者的是
①同温同压下气体CH4与NH3的密度; ②Al原子和N原子的未成对电子数;
③同温下分别在100g水中达到溶解平衡时溶解的无水CuSO4和CuSO4·5H2O的质量;④20℃时,CuSO4饱和溶液的质量分数A%和CuSO4的溶解度Bg,其中A与B的值;⑤F元素和O元素的电负性; ⑥Mg元素和Al元素的第一电离能;
⑦H原子和H+离子的半径
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.①②⑥⑦
1.下列化学用语正确的是
A.硫离子的核外电子排布式: 1s22s22p63s23p4
B.铁原子的原子结构示意图: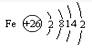
C.CO2的分子模型示意图:
D.氮分子的结构式: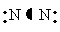
24.(11分)
下图所示物质转化中,常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
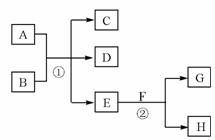
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是 ;
(2)若反应①在加热条件下进行,且C、D是两种均能使澄清石灰水变浑浊的无色气体,则反应①的化学方程式是 ;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生。在加热条件下,当A过量时反应①的离子方程式是 ;
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素构成。则A过量时反应①的化学方程式是 。
23.(8分)根据X、Y、Z、W四种常见元素的下列信息,回答有关问题:
信息1:上述四种元素均为短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息1,X一定不是 (填序号);
A.氢 B.碳 C.氧 D.硫
信息2:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素 (填“是”或“否”);
信息3:向上述四种元素的单质组成的混合物中加入足量稀盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)生成白色沉淀物的化学式为 ;
信息4:向上述四种元素的单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入足量的稀盐酸,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的化学式为 。
22.(10分)A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。
试回答下列问题:
(1)A在元素周期表中的位置是 ;
(2)C的元素名称是 ;
(3)D元素离子的结构示意图为 ;
(4)B和E可形成BE3、B2E4等化合物,BE3的电子式为 ,B2E4的结构式为 。
21.(8分)汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等。请回答下列相关问题:
(1)次氯酸盐是一些漂白剂和消毒剂的有效成分。84消毒液的有效成分是次氯酸钠,制取该消毒液的化学方程式为 ;
(2)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3溶液在一定条件下与SO2反应制得。该反应的离子方程式为 ;
(3)过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 (填序号);
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(4)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com