
10.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A.3∶4∶1 B.3∶3∶2 C.6∶7∶3 D.6∶9∶0
9.过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留固体物质是
A.Na2O2、Na2CO3
B.NaOH、Na2CO3
C.Na2CO3
D.Na2CO2、NaOH、Na2CO3
8.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O==Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-==Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
7.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
6.设NA代表阿伏加德罗常数,下列说法正确的是
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100
mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA
D.20 g重水(D2O)中含有的电子数为10NA
23.(7分)为了测定某铜银合金的成分,将30.0g该金溶于80mL13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1mol/L。假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
22.(5分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
21.(12分)某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
[提出假设]该反应中的气体产物可能是CO或者是CO2和CO的混合物。
[查阅资料]氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠 ( NaNO2)饱和溶液混合加热反应制得氮气。
[设计方案 ] 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
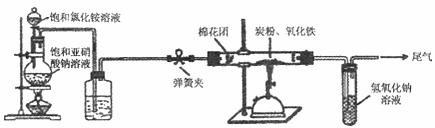
试回答下列问题:
(1)按上图连接装置,如何检查该装置的气密性
(2)广口瓶内盛放的试剂为 ,其作用为
(3)实验开始时,应先打开弹簧夹,一段时间后关闭;再点燃酒精喷灯,理由是
(4)称取3.20g氧化铁、2.00g炭粉混合均匀,放入质量为48.48g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。经进一步测定得知参加反应的氧元素质量为0.96g 。从而确认该反应的气体产物是C02和CO 的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(C02):n(CO)= 。 (5)有同学根据实验得出的结论,认为应对实验装置进一步完善,你认为应作如何改进?
20.(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:① 玻璃棒 ② 烧瓶 ③ 烧杯 ④ 胶头滴管 ⑤ 量筒 ⑥ 容量瓶 ⑦ 托盘天平 ⑧ 药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的仪器有 (填代号)。
(2)经计算,需浓H2SO4的体积为 。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 。
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到 中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2-3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处。改用 滴加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
19.(10分)(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
① 气体 ,理由是 。
② 气体 ,理由是 。
③ 气体 ,理由是 。
④ 气体 ,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com