
2.2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是 ( )

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.ETFE膜(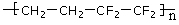 )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
D.用金属铝与V2O5冶炼钒,铝作还原剂
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是 ( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属于原子晶体
26.(7分)向100mL某二价金属M的氢氧化物澄清溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的盐酸溶液中,在标准状况下收集到4.48L气体。将滤液加水稀释到250mL,取出25mL盐酸完全反应,在标准状况下收集到1.12L气体。
(1)M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式为
(2)要计算金属M的相对原子质量,你认为还必须提供下列哪些项目的数据 ( )
A.M的氢氧化物溶液的物质的量浓度(设为2mol·L‑1)
B.M的碳酸盐的质量(设为39.4g)
C.与M的碳酸盐反应的盐酸的物质的量浓度(设为0.1mol·L-1)
D.题设条件充足,不需要补充数据
(3)根据你的选择,试计算金属M的相对原子质量和加入的NaHCO3溶液中所含溶质的质量。
25.(4分)向Cu与CuO的混合物中加入混酸(硝酸和硫酸)后加热,使之恰好完全反应,反应中不产生SO2和Cu(NO3)2,硝酸的还原产物只有NO,且得到NO 8.96L(标准状况)。将溶液冷却后刚好全部结晶(无其他任何残留物),得到250gCuSO4·5H2O。求:
(1)混酸中硝酸和硫酸的物质的量之比
(2)原混合物中Cu与CuO的物质的量之比
(3)混酸中硫酸的质量分数。(写出计算过程)
23.(9分)亚铁是血红蛋白的重要组成部分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,与VC(维生素C)同服可增加本品吸收。某同学设计实验对其中的铁成分是进行了验证。请一起完成实验:
第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2、和SO42-,也可以将Fe2+氧化成Fe3+。
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色混浊液,说明有 存在(填离子符号)。
第三步:往上述溶液中滴入几滴KSCN溶液出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是(填序号):
①药品中的铁本来就以Fe3+的形式存在:
②在制药过程中生成少量Fe3+;
③本实验过程中有少量Fe3+生成。
第四步:将第三步所得溶液分成两份,分别装在A、B两个试管中。
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。
红色变深的原因是(用离子方程式表示)
红色又逐渐褪去的原因可能是
设计实验证明你的推测
第六步:向B试管的溶液中加入一片VC,片刻后溶液红色也褪去,说明VC有 性怎样理解药品说明书中所述“与Vc(维生素C)同服可增加本品吸收”这句话?
22.(3分)下列有关实验的叙述,正确的是(填序号)
A.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
B.容量瓶检漏:在容量瓶中按容量加足水,用手压紧瓶塞倒立1min,如不渗漏,即可使用。
C.金属锂应存放在煤油中防止被氧化
D.用碱式滴定管量取20.00mL高锰酸钾溶液
E.NaOH固体可长期保存在玻璃瓶中
F.常温下铜跟稀硫酸不反应,跟浓硫酸能立即反应。
G.除去乙醇中混有的乙酸:向混合液中加入生石灰后蒸馏
H.使用PH试纸的第一步操作是把试纸用蒸馏水湿润
I.为了防止容量瓶漏水,可在玻璃塞上涂上凡士林
J.在氢氧化铁胶体中加注放量硫酸或氢氧化钠均会产生沉淀
K.要探究纯碱溶液呈碱性是由CO32-引起的,可向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱呈碱性是由CO32-引起的。
21.(9分)氨可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+、N4H44+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,有类似于NH4+的性质。N4H44+,遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
(1)1个N3-离子含有 个电子,NH2-的电子式为 。
(2)形成N2H5+离子的中性分子的分子式是 。
(3)写出N2H62+离子在强碱溶液中反应的离子方程式 。
(4)N4和N2的关系正确的是 (填序号)
(A)同种单质 (B)同位素 (C)同分异构体 (D)同素异形体
(5)N4H4(SO4)2 (填“能”或“不能”)和草木灰(主要成分为碳酸钾)混合施用。
(6)已知液氨中存在着下列平衡:2NH3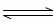 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
。
20.(8分)对溶液中的反应,下列图象中n表示生成沉淀的物质的量,v表示参加反应的一种反应物的物质的量,根据相关图象回答问题:
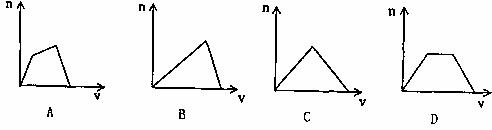
(1)反应过程产生沉淀量符合A图像的两种反应物为 。
(2)反应过程产生沉淀量符合B图像的离子反应物为 。
(3)反应过程产生沉淀量符合C图像的离子反应物为 。
(4)反应过程产生沉淀量符合D图像的离子反应物为 。
19.(3分)有下列物品或设备:①陶瓷餐具 ②砖瓦 ③水泥路桥 ④门窗玻璃 ⑤水晶镜片
⑥石英钟表 ⑦玛瑙手镯 ⑧硅太阳能电池 ⑨光导纤维 ⑩计算机芯片(用①②等符号表示)
其中用到硅单质的是 ;
所用材料为SiO2或要用到SiO2的是 ;
所用材料为硅酸盐的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com