
25.(5分)向Wg由NaHS、Na2SO3 、CuSO4组成的混合物中,加入一定量的水充分反应后过滤。滤液中只含有Na2SO4,滤渣不溶于稀盐酸,且反应过程中无气体逸出。(已知:把H2S通入CuSO4溶液中会发生下列反应:H2S+CuSO4=H2SO4+CuS↓)
(1)滤渣的成分是___________。
(2)原混合物中NaHS、Na2SO3、CuSO4的物质的量之比是______________。
(3)用离子反应方程式表示滤渣的形成过程_____________________________,
24.(8分)将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克。则
(1)剩余固体是 (化学式),
(2)原混合物中Na2CO3的物质的量是 mol。
(3)已知Na2CO3和稀盐酸反应分两步进行:
Na2CO3+HC1→NaC1+NaHCO3
NaHCO3+HC1→NaC1+CO2↑+H2O
若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如下图像:
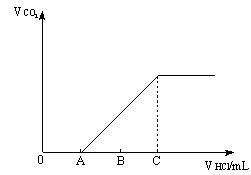
求:A点对应溶液的溶质是 (填化学式);C点时消耗盐酸的体积是 mL。
23.(10分)聚丙烯酰胺主要用于水的净化处理、纸浆的加工等。丙烯酰胺是一种不饱和酰胺,是生产聚丙烯酰胺的原料。其结构简式为:
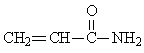
丙烯酰胺可由化合物A(分子式C3H6)经几步反应制得,反应过程如下:
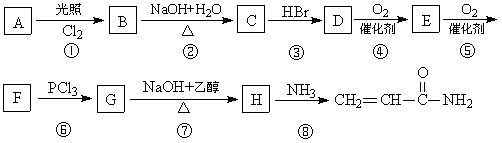
已知:(1)3RCOOH+PCl3 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3 RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)关于丙烯酰胺的下列叙述中正确的是:
A.能使酸性KMnO4溶液褪色;
B.能发生加聚反应生成高分子化合物;
C.与α-氨基乙酸互为同系物;
D.能与H2发生加成反应
(2)写出D E的反应方程式:
E的反应方程式:
(3)C D的目的是
;上述反应过程中属于取代反应的是:
。
D的目的是
;上述反应过程中属于取代反应的是:
。
(4)丙烯酰胺在一定条件下能发生水解反应,试写出其在NaOH溶液中水解的化学方程式:
(5)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种,试写出2种:
①链状,无碳碳叁键;
②同一个碳原子上不能同时连有-NH2和-OH或双键和-NH2(-OH);
③同一个碳原子上不能连有2个双键。
22.(10分)N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)
 4NO2(g)+O2(g)
;⊿H>0
4NO2(g)+O2(g)
;⊿H>0
①若反应达到平衡后,通入一定量氮气,则N2O5的转化率将______(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2________T1.
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成(“阴极”或“阳极”),其电极反应式为
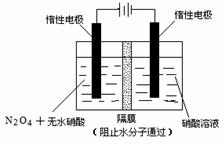
21.(9分) 甲、乙、丙、戊的空间结构都是正四面体,单质甲和化合物乙在高温下可以发生置换反应,丙、丁、戊三种粒子含有相同的电子数,戊是一种阳离子。丁在常温下呈液态,它能电离生成2种等电子的微粒。
(1)写出单质甲和化合物乙发生的化学方程式
(2)丙是天然气的主要成分,丙和丁在催化、加热的条件下,能得到2种可燃性的气体,写出该化学方程式 ,丙和空气可作燃料电池,写出在碱性介质中该电池的正极反应式 。
(3)写出丁电离生成2种等电子微粒的电离方程式
(4)室温下,含有戊的盐溶液的PH 7(填“大于”、“小于”或“不能确定”)。
20.(9分)用下图所示装置进行实验,将A逐滴加入B中:
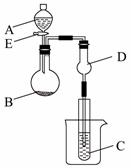
(1)若A为浓H2SO4,B为第三周期金属元素的单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是 (填化学式),B与浓H2SO4溶液反应的化学方程式为 ;反应后往烧杯中加入沸水,又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 。
然后往烧杯中加入沸水,可观察到试管C中的现象是 。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 与葡萄糖的混合液,仪器D在此实验中的作用是 。
19.(3分)下列有关实验的叙述,正确的是 。
A.为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
B.制乙烯时,温度计应插入反应混合液中
C.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
D.用酸式滴定管量取20.00mL高锰酸钾溶液
E.配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F.证明淀粉已水解,向淀粉溶液中加入稀硫酸,水浴加热一段时间后加入银氨溶液,使其发生银镜反应
G.用溴水除去乙烯中混有的二氧化硫气体
18.下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 ( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
第Ⅱ卷(非选择题 共54分)
17.肉毒碱是一种具有多种生理功能的氨基酸类物质,又名维生素Bt,是一种类维生素。1927年测定了它的结构,1958年发现其能促进脂肪代谢,1985年被指定为“多功能营养品”。下列有关肉毒碱的说法不正确的是: ( )
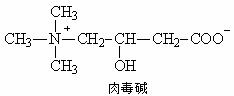
A.肉毒碱的分子式为:C7H15NO3
B.肉毒碱能与氢氧化钠反应但不能与盐酸反应
C.一定条件下肉毒碱能发生酯化反应、消去反应、取代反应
D.肉毒碱能溶于水,难溶于苯
16.如下图,B为常见金属或非金属单质,有下列转化关系:
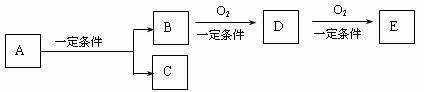
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 ( )
A.NaCl B.AlCl3 C.H2O2 D.KCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com