
4.用石灰水、小苏打、淀粉和食醋等不能完成的实验是 ( )
A.碘盐中碘元素的检验 B.暖瓶中水垢的除去
C.食盐和纯碱的鉴别 D.鸡蛋壳主要成分的检验
3.下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是
( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
2.下列化学式既能表示物质的组成,又能表示物质的一个分子的是 ( )
A.NaOH B.SiO2 C.Fe D.CO2
1.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是 ( )
A.CO2的电子式 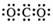 B. Cl-的结构示意图
B. Cl-的结构示意图 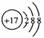
C.乙烯的结构简式 C2H4 D.质量数为37的氯原子 17 37Cl
31.为了防环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH3HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4SO4的分解温度均高于200℃],测得有关实验数据如下(气体体积均折算到标准状况的体积):
|
实验序号 |
样品质量(克) |
NaOH溶液的体积(mL) |
氨气的体积(L) |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
IV |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为:
; 。
(2)计算用1.85克样品进行同样实验时,生成氨气在标准状况的体积为 L。
(3)计算确定该混合物中(NH4)2SO4和NH4GSO4的物质的量之比 。
(4)欲计算该NaOH溶液的物质的量浓度应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。
30.将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克。
则
(1)剩余固体是 (化学式),
(2)原混合物中Na2CO3的物质的量是 mol。
(3)已知Na2CO3和稀盐酸反应分两步进行:
Na2CO3+HC1→NaC1+NaHCO, NaHCO3+HC1→NaC1+CO2↑+H2O,若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如下图像:
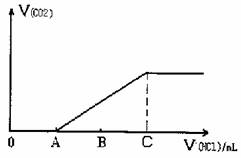
求:A点对应溶液的溶质是 (填化学式);C点时消耗盐酸的体积是 mL。C点时产生的CO2的体积在标况下是 L。
29.茉莉花是一首脍炙人口的民歌。茉莉花香气的成份有多种,乙酸苯甲酯
(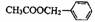 ),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
),是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇
为原料进行人工合成。一种合成路线如下:
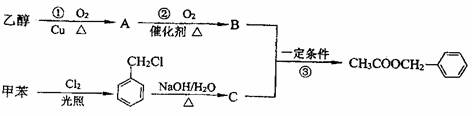
(1)C的结构简式为 。
(2)写出反应①的化学方程式: 。
(3)反应③的化学方程式: 。
其反应类型为 。
(4)反应 (填序号)原子的理论利用率为100%,符合绿色化学的要求。
(5)写出符合下列条件的乙酸苯甲酯一种同分异构体:①含苯环结构 ②具有酯的结构: 。
(6)指出乙醇的两个重要用途 、 。
28.乙烯是一种重要的石油化工原料,以乙烯为原料在不同条件下可合成下列物质:
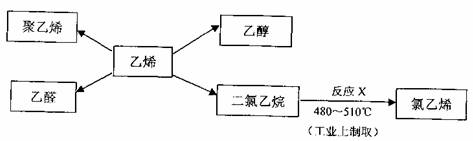
完成下列各题:
(1)工业从石油制取乙烯的方法是 (填编号)
a常压蒸馏 b减压蒸馏 c裂化 d裂解
(2)下列关于聚乙烯的说法正确的是 (填编号)
a取乙烯是混合物 b聚乙烯是乙烯互为同系物
c聚乙烯中含有碳碳双键 d聚乙烯不可用作食品塑料袋
(3)写出乙醇的同分异构体 (写结构简式)
(4)写出反应X的化学方程式 ,该反应类型为 。
(5)证明一瓶乙醛溶液部分被氧化的化学试剂是 (填编号)
a银氨溶液 b金属钠 cNaHCO3溶液 d酚酞试液
(6)已知乙烯分子是平面结构,且双键不能旋转。若分子中两上氢原子被氯原子取代,
可得到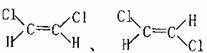 则这两种分子属于
(填同种物质或同分异构体)
则这两种分子属于
(填同种物质或同分异构体)
27.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
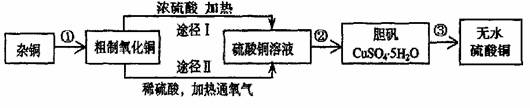
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a蒸发皿 b石棉网 c泥三角 d表面皿 e坩埚钳 f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是 。
a灼烧过程中部分氧化铜被有机物还原与铜
b灼烧不充分铜未被完全氧化
c氧化铜在加热过程中分解生成铜
d该条件下铜无法被氧气氧化
(3)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II优点有 (填序号)。
①产生等量有胆矾,II耗酸量比I少
②II不产生有毒气体
③用相同量含有粗铜的氧化铜,II比I制得的胆矾多
(4)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
次
(5)若测定结果x值偏高,可能的原因是 。
a加热温度过高 b胆矾晶体的颗粒较大
c加热时胆矾晶体溅出 d胆矾晶体部分风化
(6)实验室中若要完成步骤③,一般将胆矾放在 (填仪器的名称)加热。实验中往往由于操作不当,得到的无水硫酸铜是灰色的,通过分析可知灰色粉末成分是硫酸铜和 (填化学式)组成的混合物
26.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
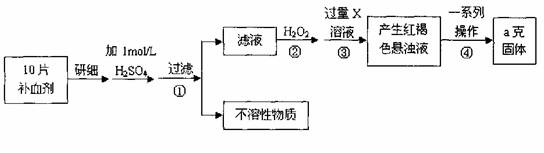
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O为片剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com