
26.(8分)在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体amL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即x=a),则原混合气体中CH4的体积分数是 ;
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是 ,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其它数据可以是 (填选项字母);
A.2a mL混合气体的密度 B.生成CO2气体的总体积
C.生成H2O(g)的总质量
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是 。
25.(10分)已知:①醛在一定条件下可以两分子加成:
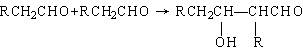
产物不稳定,受热即脱水而成为不饱和醛。
②B是一种芳香族化合物。根据下图所示转化关系填空(所有无机物均已略去)
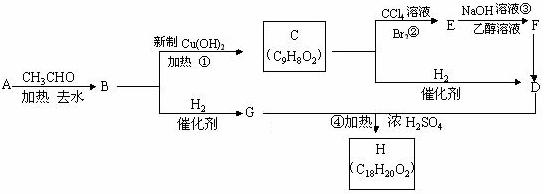
(1)写出B、F的结构简式:
B ;F 。
(2)写出②和③反应的反应类型:
② ;③ 。
(3)写出G、D反应生成H的化学方程式: 。
(4)F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为 mol。
24.(8分)实验室制备溴乙烷(C2H5Br)的原理为C2H5OH+NaBr+H2SO4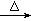 NaHSO4+C2H5Br+H2O,装置如下图(已知溴乙烷的沸点38.4℃)和步骤如下:
NaHSO4+C2H5Br+H2O,装置如下图(已知溴乙烷的沸点38.4℃)和步骤如下:
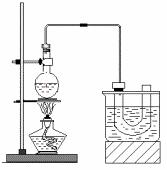
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入研细的13g溴化钠和几粒碎瓷片,然后加入10mL95%乙醇、28mL78%浓硫酸;
③小心加热,使其充分反应。
回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________ ___
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(3)U型管内可观察到的现象是______________。
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的______(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是__________(填仪器名称)。要进一步制得纯净的C2H5Br,可用水洗、分液,然后向油层中加入无水CaCl2,再进行_______________(填操作名称)。
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
23.(10分)以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题:
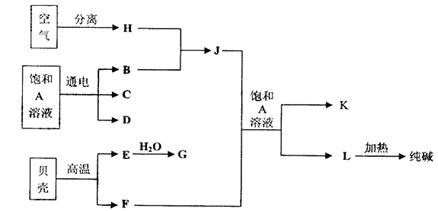
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为
(2)电解A溶液反应的离子方程式为
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有(填字母序号) ;
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(4)将F和J通入A的饱和溶液中的顺序为
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
|
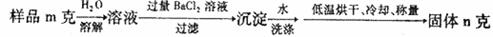
①检验沉淀是否洗涤干净的所用到的试剂是
②样品中NaCl的质量分数的数学表达式为:
22.(共10分)已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是:
A ;B ;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,写出化学方程式
若C为第一和第二周期元素组成的化合物。
①C的溶液中加入少量的二氧化锰,有无色气体生成
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做 剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
21.(4分)已知有以下物质相互转化
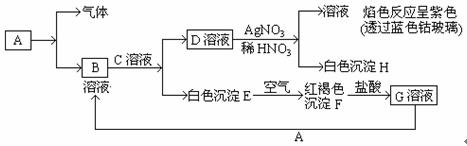
试回答:
⑴写出B的化学式 。
⑵向G溶液中滴加KSCN的实验现象是____
⑶向G溶液加入A的有关离子反应方程式
20.在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-bmol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示。
|
序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
假设溶液混合前后体积变化忽略不计,则c为 ( )
A.3 B.4 C.5 D.6
第Ⅱ卷(非选择题,共50分)
19.将1.92g铜粉投入到一定量的浓硝酸中反应,当铜完全作用时,生成的气体颜色越来越浅,共收集到气体672ml(标况下),将盛有此气体的容器倒扣在水槽中,通入标准状况下的一定体积的氧气,恰好使气体完全溶于水,则所通入氧气的体积为 ( )
A.504ml B.336ml C.224ml D.168ml
18.铜板上铁铆钉处的腐蚀原理如下图所示,下列有关说法中,错误的是 ( )
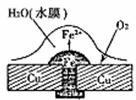
A.正极电极反应式为:O2 +2H2O+4e-= 4OH-
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铁先被腐蚀
D.此过程中电子由铜板流向铁
17.取体积相同的KI、Na2S和FeBr2溶液,分别通入足量氯气当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2S、FeBr2溶液的物质的量浓度之比为( )
A.6:3:2 B.2:1:3 C.2:1:2 D.3:7:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com