
3.白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程是:白
磷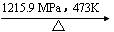 黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是( )
黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是( )
A.黑磷与白磷是同分异构体 B.黑磷能导电
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
2.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是 ( )
A.N4和N2互为同素异形体
B.N4形成的晶体为原子晶体
C.相同质量的N4和N2所含原子个数比为1:2
D.N4的摩尔质量是56g
1.下列物质中不会因见光而分解的是 ( )
A.NaHCO3 B.HNO3 C.AgI D.HClO
29.(14分)等物质的量的NaHCO3和KHCO3的混合物4.6g,与1.0mol/L的盐酸反应:
(1)试分析,欲求标准状况下生成的CO2气体的体积时,还需要什么数据______________(用a表示,并注明单位)。
(2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
|
|
所需数据取值范围 |
生成CO2气体的体积 |
|
盐酸不足量时 |
|
|
|
盐酸足量时 |
|
|
(3)若NaHCO3和KHCO3的物质的量不相等,则4.6g的混合物与足量盐酸完全反应时,标准状况下生成的CO2气体的体积大于___________L,小于____________L(结果保留两位小数)。
28.(14分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为__________________________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小 于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则___________(填“甲”或“乙”)判断正确。试剂X是_____________(填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则___________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言___________(填“甲”或“乙”)判断是错误的,理由是_______________________________________________。
27.(12分)已知物质A是由三种元素组成的化合物,其焰色反应为黄色。B、C、D、K都是单质,反应①-⑤都是工业生产中常见的反应。各物质之间的相互转化关系如下图所示。
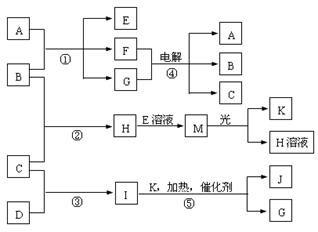
请填写下列空白:
(1)写出下列物质的化学式:B___________________;J__________________。
(2)写出反应H+E(溶液)→M的离子反应方程式_________________________________。
(3)写出反应④的化学方程式__________________________,其阴极产物为__________。
(4)化学反应的反应热(△H )与反应物和生成物的键能(E)有关,已知B、C、H中化学键键能分别为274KJ/mol、436KJ/mol、434KJ/mol,请写出反应②热化学方程式_______。
26.(20分)现有A、B、C、D、E、F六种原子序数依次增大的前四周期主族元素,且分属四个不同周期,A、E同主族,B、C、D为同周期相邻的三种元素,其中B元素形成的化合物种类是所有元素中最多的,D、E简单离子具有相同的电子层结构,F与B可形成FB2型离子化合物。请填写下列空白:
(1)C是___________,F是___________。D在周期表中的位置为__________________。D与E按原子个数比1∶1形成的化合物的电子式为________________________。
(2)B可形成多种同素异形体,其中一种同素异形体熔沸点很高,硬度大,该同素异形体的晶体类型为_________________,含有1mol B原子的该晶体中含有的共价键的数目为_____________。
(3)由A、B、D、F四种元素组成的化合物与过量的E的最高价氧化物对应水化物反应的离子方程式为___________________________________________。
(4)C与E形成的一种化合物中,E元素的质量分数为35.4%,该化合物的摩尔质量不超过70g/mol,则该化合物的化学式为__________________,其中可能含有的化学键为__________________________,已知该化合物在水中可以发生水解,其水解的离子方程式为________________________________________________。
13.已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
第Ⅱ卷(非选择题,共174分)
12.氯气与碘在加热的条件下以一定比例反应可得的一红棕色液体ICl(氯化碘),ICl的性质类似于卤素,有很强的化学活动性。
例如:ICl + H2O = HCl
+ HIO,2Zn + 2ICl = ZnCl2 + ZnI2 ,下列叙述正确的是 
A.在Zn跟ICl的反应中, ZnI2既是氧化产物又是还原产物
B.在H2O跟ICl的反应中,ICl是氧化剂,H2O是还原剂
C.在Zn跟ICl的反应中,ZnCl2既是氧化产物又是还原产物
D.在H2O跟ICl的反应中,ICl既是氧化剂又是还原剂
11.甲、乙、丙三种溶液各含有一种X-离子(X-为Cl-、Br-、I-),向甲中加淀粉和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有 
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com