
9.溶液的配制过程能引起浓度偏高的是
①用1g 98%的浓硫酸加4g水配成1:4(体积比)的硫酸。②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线。③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液。④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液。⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水。
A.①③⑤ B.②④⑤ C.③④ D.④⑤
8. 在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
7. 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
6. 在10mL 0.15mol/L Fe2(SO4)3、10mL 0.2mol/L KAl(SO4)2和20mL 0.3mol/L (NH4)2SO4三种溶液中,分别加入足量的BaCl2溶液,所得沉淀质量依次为xg、yg、zg,则它们的关系为
A.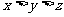 B.
B.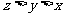 C.
C.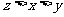 D.
D.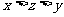
5.发射“神舟六号”载人飞船的火箭所用燃料为偏二甲肼,偏二甲肼的分子式为C2H8N2,燃烧时所用的氧化剂是N2O4,燃烧产物只有N2、CO2和H2O,在该反应中被氧化的氮原子和被还原的氮原子物质的量之比为
A.1∶2 B.2∶1 C.3∶4 D.4∶3
4.下列各组混合物的分离或提纯方法不正确的是
A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
B.用结晶法提纯NaCl和KNO3的混合物中的KNO3
C.用蒸馏法分离乙醇和苯酚的混合物
D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
3. NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10 NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5 NA
2. 五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
① 新制氯水久置后→浅黄绿色消失; ② 淀粉溶液遇单质碘→蓝色;
③ 溴化银见光分解→银白色; ④ 热的黑色氧化铜遇乙醇→红色
⑤ 鸡蛋白溶液遇浓硝酸→黄色; ⑥ 苯酚在空气中氧化→粉红色
A.①②③④⑤ B.②③④⑤⑥ C.①②④⑤⑥ D.①③④⑤⑥
1. 下列各组物质的分类正确的是
① 混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
② 电解质:明矾、冰醋酸、石膏、纯碱
③ 非极性分子:CO2、CC14、CH2C12、对二甲苯
④ 同位素:1H+、2H2、3H
⑤ 同素异形体:C60、C80、金刚石、石墨
⑥ 同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦ 同分异构体:乙二酸二乙酯、乙二酸乙二酯,二乙酸乙二酯
A.②⑤ B.②④⑤⑦ C.②⑤⑥⑦ D.全部正确
29.(8分)有些煤炭中,硫元素是以FeS2 形式存在,在有水和空气及脱硫微生物存在的条件下,发生生物氧化还原反应,其相关的离子方程式为(以下反应都在微生物作用下进行):
2FeS2 + 7O2 + 2H2O = 4H+ + 2Fe2+ + 4SO42-
4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O
FeS2 + 2Fe3+ = 3 Fe2+ + 2S
2S + 3O2 + 2H2O = 4H+ + 2SO42-
请回答下列问题:
(1)总的化学反应方程式为:
(2)FeS2 最终被 氧化,转化为 从煤炭中分离出去
(3)某大型电厂使用的煤炭中含FeS2 的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上能回收硫酸 吨;硫酸亚铁 吨。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com