
9.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是 ( )
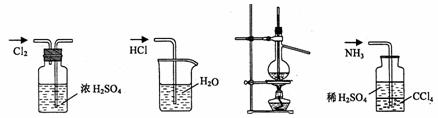
A.干燥Cl2 B.吸收HCl C.石油的蒸馏 D.吸收NH3
8.下列各组物质中,不能按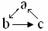 (“→”表示一步完成)的关系相互转化的是( )
(“→”表示一步完成)的关系相互转化的是( )
|
选项 |
a |
b |
c |
|
A. |
Fe |
FeCl3 |
FeCl2 |
|
B. |
Cl2 |
NaClO |
NaCl |
|
C. |
Si |
SiO2 |
H2SiO3 |
|
D. |
HNO3 |
NO |
NO2 |
7.下列反应的离子方程式正确的是 ( )
A.足量的氯气通入溴化亚铁溶液 2Cl2+2Fe2++2Br-==4Cl-+2Fe3++Br2
B.少量的二氧化硫通入次氯酸钠溶液 SO2+ H2O+2ClO-==SO32-+2HClO
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.Fe(NO3)3溶液中加入过量的HI溶液: Fe3++NO3-+4I-+4H+=Fe2++2I2+NO↑+2H2O
6.下列反应所得溶液中一定只含一种溶质的是 ( )
A.向稀硝酸中加入铁粉
B.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向NaOH溶液中通入CO2气体
23.(7分)将2.5克碳酸钠.碳酸氢钠和氢氧化钠的固体混合物完全溶于水制成稀溶液,然后向该溶液中逐滴加入1mol/L盐酸。所加入盐酸溶液的体积与产生二氧化碳(标准状况)的关系如图所示。
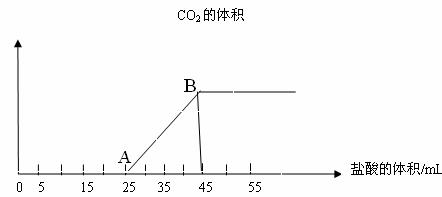
(1)写出OA段所发生反应的离子方程式: 。
(2)当加入35mL 盐酸时,所产生的二氧化碳的体积(标准状况)是 。
(3)计算原混合物中Na2CO3的质量分数。
22.(6分)某工厂废气中含有SO2,可将SO2转化为(NH4)2SO4而除去。其过程为:将废气经初步处理,使其中O2的体积分数为10%(这时SO2的体积分数为0.2%),并在400℃时以5m3/h的速率通过V2 O5触媒层,然后与流量为25 L/h的NH3混合,再喷入流量为290 g/h的冷水,此时气体温度迅速从400℃下降至200℃,在结晶装置中得到(NH4)2SO4晶体。回答下列问题。
(1)使废气中SO2与O2的物质的量之比为1:50,主要原因是 。
(2)反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表:
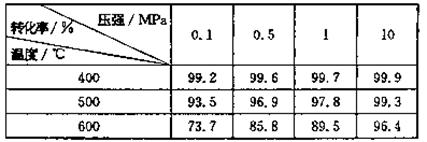
已知SO2的氧化是放热反应,利用表中数据推断工业上应选用的生产条件是 ,选择该条件的主要原因是 。
(3)有资料报道:“最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3。”
你认为该报道可信吗? (填“可信”或“不可信”),其理由是
(4)合成氨时,原料N2不能用空气代替,主要原因是 。
21.(8分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
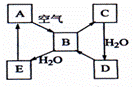
(1)写出A在周期表中的位置:____________________
(2)写出E与A的氢化物反应生成A的化学方程式___________
(3)E在空气中容易变质而生成D,写出该反应的化学方程式__________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
反应后溶液中各离子浓度由大到小的排列顺序是: 。
20.(5分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
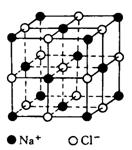
①将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到容量瓶中;②用滴定管向容量瓶中加苯,不断振荡,继续加苯到容量瓶的刻度,计算出NaCl固体的体积Vcm3。请回答下列问题
(1)步骤②中用酸式滴定管还是用碱式滴定管? 理由是
(2)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为acm(如上图),用上述测定方法测得的阿伏加德罗常数NA的表达式为 。
19.(11分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为__。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为__。
(3)X的硝酸盐水溶液显酸性,用离子方程式解释原因__。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为__。
(5)比较Y、Z气态氢化物的稳定性__>__(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:(用离子符号表示)
__>__>__>__。
(7)Y的最高价氧化物对应水化物为酸,含0.25 mol该酸的稀溶液与足量的W的最高价氧化物的水化物反应,并放出Q KJ的热量。写出该反应的热化学方程式:_______。
18.(8分)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子八种微粒(离子或分子)。请回答:
⑴A元素是 ,B元素是 (用元素符号表示)。
⑵D是由两种元素组成的双原子分子,其分子式是 。
⑶E是所有含18个电子的微粒中氧化能力最强的分子,其电子式是 。
⑷F是由两种元素组成的三原子分子,其分子式是 。
⑸H分子中含有8个原子,其结构式是 。
⑹G分子中含有4个原子,G与C2-在酸性条件下反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com