
7.下列有关比较中,大小顺序排列错误的是 ( )
A.物质的熔点:石英>食盐>冰>汞
B.热稳定性:PH3>H2S>HBr>NH3
C.结合质子(H)的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
6.在一定温度下体积固定的密闭容器中,当下列物理量①混合气体的压强②气体的总物质的量③混合气体的密度④B的物质的量浓度不再变化时,能表明可逆反应A(s)+2B(g)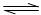 C(g)+D(g)已达平衡的是 ( )
C(g)+D(g)已达平衡的是 ( )
A.①② B.①④ C.③④ D.只有④
5.设NA为阿佛加德罗常数,下列说法正确的是 ( )
A.室温下,8g甲烷含有共价键数为2NA
B.1L2mol·L-1的MgCl2溶液中含Mg2+数为2NA
C.标准状况下,11.2L的SO3所含分子数为0.5NA
D.23g钠在氧气中完全燃烧失去电子数为0.5NA
4.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是 ( )
A.Fe3+ B.Fe2+ C.NH4+ D.Al3+
3.下列各组物质的类别归属正确的是 ( )
A.同位素:1H2、2H2、3H2 B.化合物:重水、双氧水、矿泉水
C.非电解质:Cl2、BaSO4、C2H5OH D.分子晶体:I2、SO3、固态氩
2.下列有关非金属的说法中正确的是 ( )
①常温下为气体的单质都是由非金属组成
②非金属氧化物都可以与水反应生成酸
③非金属元素都是主族元素,其最外层电子数都大于等于4
④因为非金属具有得电子的性质,其单质均不能作还原剂
A.①正确 B.①③正确 C.②④正确 D.都不正确
1.生活中碰到的某些问题常涉及到化学知识,下列叙述中正确的是 ( )
A.家庭可以用明矾将自来水净化成纯净水
B.淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物
C.大气污染物SO2、CO和NO2主要来源于煤的燃烧和汽车排放的尾气
D.变、质的油脂有难闻的特殊气味,是由于油脂发生了物理变化
31.向一密闭容器中加入2molA、0.6molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变的反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
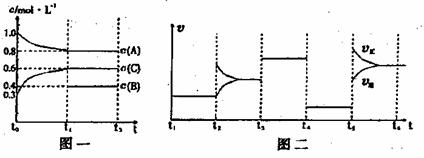
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。该反应方程式可表示为 各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5(用>、<、=)
(3)在相同条件下,若起始时容器中加入a molA、b mol B和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。(含a,b,c的代数式表示)
附加题:(本题共10分)
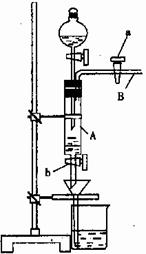
莫尔是一位著名分析化学家,以他命名的莫尔盐[(NH4)2Fe(SO4)2·6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用,某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。然后用莫尔盐测定未知高锰酸钾溶液的浓度。
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是:
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是 。
(3)取3.92g莫尔盐晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ - Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
30.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大小”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 (填序号)。
A.Ba(OH)2溶液 B.BaC12溶液
C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断错误的,理由是 。
29.氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
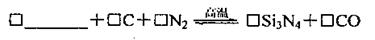
(1)补充并配平上述反应的化学方程式(填写化学式和化学计量数)。
(2)该反应的平衡常数表达式为K= ;升高温度时平衡常数减小,则其反应热△H 零(填“大小”、“小于”或“等于”);若在一定温度下,当上述反应达到平衡时增加氮气的流量,平衡常数将 (填“增大”、“减小”或“不变”)。
(3)当制得14g Si3N4时,碳作为 剂将 (填“得到”或“失去”) mol电子,所得的CO为 产物(填氧化或还原);增加碳的用量时平衡 (填“正向移动”、“逆向移动”或“不移动”。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com